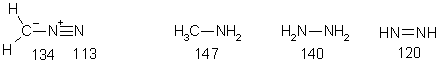
Диазосоединения
Строение диазогруппы
Диазониевая группа состоит из sp-гибридных атомов азота, и, соответственно, имеет линейную геометрию. Длина связи N-N короче, чем в соединениях с одинарными и двойными N-N-связями и колеблется около значения 110 пм. Это означает, что данную связь можно рассматривать как почти чисто тройную. В качестве подтверждения это вывода может служить тот факт, что полоса валентных колебаний диазогруппы в ИК спектрах лежит в области 2300…2000 см-1, в области, которая характерна для максимумов поглощения тройных связей.
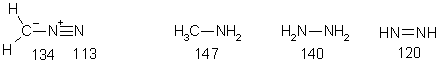

Электронное строение диазометана можно представить следующими резонансными структурами:
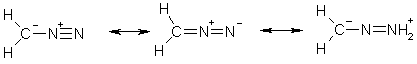
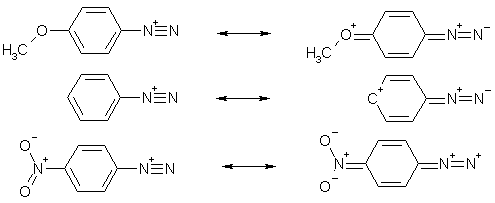
В катионе фенилдиазония положительный заряд делокализован с участием π-электронной системы кольца, что снижает энергию частицы. В то же время сопряжение дизогруппы с кольцом увеличивает порядок C-N-связи. Все это делает катионы арилдиазониев намного более термодинамически стабильными системами в сравнении с алкилдиазониями.

Как показывают данные квантовомеханических расчетов, положительный заряд присутствует на обоих атомах азота, на концевом – он вдвое меньше (+,0270), чем на центральном (+0,5842).
Разница длин связей N-N в солях диазония (109 пм) и в ковалентных дизазосоединениях (113 пм) свидетельствует, что «кумуленовая» граничная форма вносит больший вклад в состояние нейтральных диазосоединений нежели в состояние катионов арилдиазония. Это подтверждается большей устойчивостью нейтральных диазосоединений.
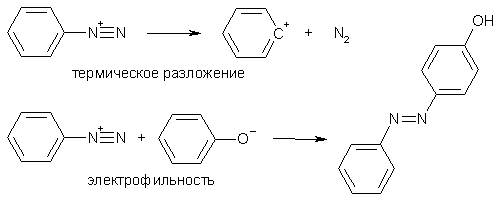
Понятия «устойчивость» и «реакционная способность» тесно связаны отношением: чем более устойчиво соединение, тем ниже его активность в химических реакциях. Говоря об устойчивости диазосоединений, имеют в виде два типа: термодинамическую и кинетическую. Термодинамическая устойчивость относится к способности в ходе разложения отщеплять молекулу азота, тогда как кинетическая устойчивость характеризует степень электрофильности диазосединения.
Ковалентные диазосоединения, в которых диазогруппа сопряжена с кратными связями, например, диазопиразол или диазоурацил, термодинамически весьма устойчивы. Так, 5-диазоурацил не изменяется при нагревании в кристаллическом состоянии до 120оС, 3-диазопиррол может без разложения перегоняться с водяным паром.
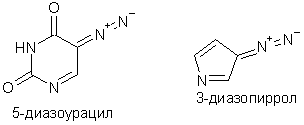
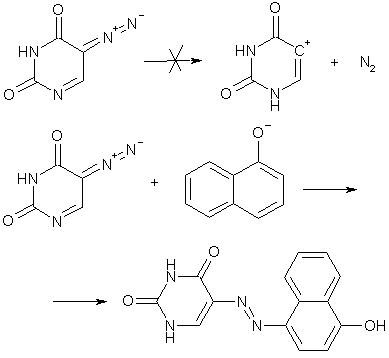
Многим нейтральным диазосоединениям свойственна также высокая кинетическая устойчивость и лишь некоторые из них могут вступать в качестве диазосоставляющей в реакции азосочетания при обычных условиях.
Термодинамическая стабильность солей диазония, которую можно оценить их отношением к нагреванию, приводящему к разложению с выделением азота, заметным образом определяется характером и расположением заместителей в ароматическом кольце. Термическое разложение солей замедляется при введении в пара-положение как донорных, так и акцепторных заместителей, обладающих мезомерным эффектом.
Кинетическая стабильность, т.е. электрофильная активность арилдиазониев также сильно зависит от заместителей в кольце. Так, реакция азосочетания с фенолами ускоряется акцепторными заместителями и замедляется донорными. Однако влияние природы заместителей на термодинамическую устойчивость и электрофильность зачастую не совпадают, что наглядно иллюстрирует сравнение относительных скоростей реакции разложения азосочетания трех катионов фенил-, пара-метоксифенил и пара-нитрофенилдиазония:
Относительные скорости реакции:
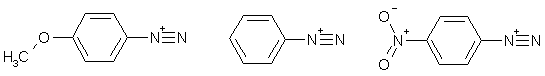
разложение
0,11
740
3,1
сочетание с фенолом 0,1
1
1300
Механизм влияния заместителей легко представить с помощью резонансных структур, в которых заместитель включен в общую систему распределения электронной плотности