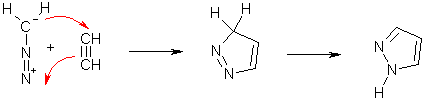Диазосоединения
Реакции диазосоединений без выделения азота
Реакции азосочетания
Наличие положительного заряда на центральном атоме азота придает катионам диазония и нейтральным диазосоединениям свойства слабых N-электрофилов. Несмотря на то, что положительный заряд на концевом атоме азота почти в два раза меньше, чем заряд на центральном атоме азота реагирующим электрофильным центром является концевой атом азота.
![]()
Реакция азосочетания представляет собой бимолекулярное электрофильное замещение (SE2) атома водорода при электроноизбыточном атоме углерода, когда в качестве электрофила выступает диазониевый ион. Для описания реакций азосочетания часто применяют специальную терминологию: нуклеофильный реактант называют «азосоставляющей», электрофильный – «диазосоставляющей». В качестве азосоставляющей чаще всего выступают высоко p-избыточные ароматические субстраты – фенолы (предпочтительно в форме фенолятов), ариламины, гетероциклы.
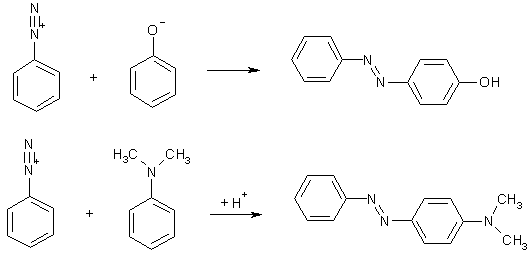
Продукты реакции содержат -N=N-группу и называются азосоединениями, многие из них являются азокрасителями. Следует подчеркнуть, что окраска вещества, обусловленная присутствием в молекуле хромофора (в данном случае – диазогруппы), является необходимым, но недостаточным условием принадлежности соединения к красителям. Молекула окрашенного соединения должна иметь заместители, которые углубляют окраску и обеспечивают прочную связь с волокном (хлопком, шерстью и др.). Такие заместители называются ауксохромами. К ним относятся группы –OH, -NR2, -SO3H, -CN.
Сочетание с фенолами проводят в слабощелочной среде (pH 8-9), что обеспечивает необходимую концентрацию фенолят-ионов, являющихся более сильными нуклеофилами, чем фенол; в сильнощелочной среде реакция не идет из-за превращения диазосоставляющей в инертный диазотат (см. ниже). Амины лучше всего сочетаются в слабокислой или нейтральной среде (pH 4-7); сильнокислая среда пассивирует амин за счет протонирования.
Диазониевые ионы активно сочетаются с СН-кислотами типа β-дикетонов и β-кетоэфиров, производных малоновой кислоты, особенно в присутствии оснований; это неудивительно, т.к. электронное строение азосоставляющих – енолов и енолят-ионов – имеет много общего с фенолами и фенолятами. Продукт данной реакции существует в виде смеси таутомерных форм азоенола (А) и кетогидразона (Б), причем преобладает последняя.
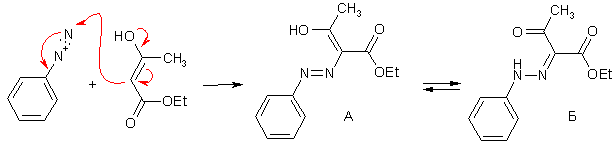
Если при активном центре СН-кислоты имеется карбоксильная группа, то она в ходе азосочетания легко отщепляется путем декарбоксилирования. Как и в случае β-кетокарбоновых кислот, декарбоксилирование протекает через шестицентровое циклическое переходное состояние.
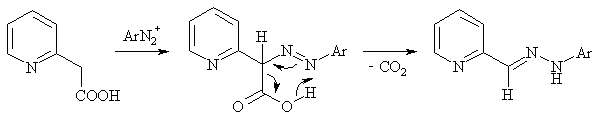
Взаимодействие с гетероатомными нуклеофилами
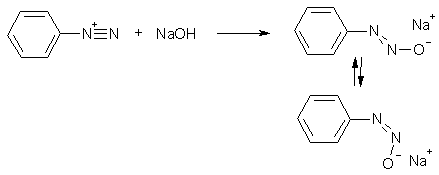
Соли арилдиазония вступают в реакции с субстратами, в которых нуклеофильный центр локализован не на атоме углерода, но на атомах других элементов: азота, кислорода, серы и др. Так, при подщелачивании раствора (нуклеофилом является гидроксид-иол) соли арилдиазония образуется сначала ковалентный аддукт – диазогидрат, а затем, при повышении pH – ионное соединение, называемое солью диазотовой кислоты, или диазотатом. Как и другие азосоединения, диазогидрат и диазотат существовуют в виде син- и анти-изомеров. анти- (транс)-Изомеры устойчивее син-изомеров, хотя последние могут быть получены и зафиксированы в растворе.
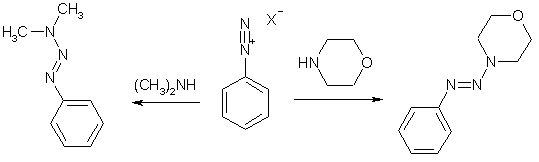
Присоединение к диазогруппе азотцентрированных нуклеофилов можно проиллюстрировать на примере диалкиламинов: выделенная соль диазония в безводной среде быстро реагирует с диметиламином или морфолином, давая соответствующие триазены.
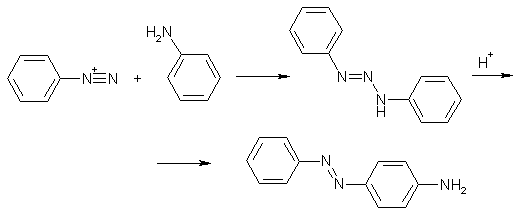
При диазотировании анилина иногда наблюдается побочная реакция образования дифенилтриазена (N-фениламиноазобензола), который является продуктом сочетания фенилдиазония с аминогруппой не подвергшегося диазотированию анилина. Обычно это происходит при недостаточной концентрации минеральной кислоты в реакционной смеси. N-Фениламиноазобензол под действием сильных кислот перегруппировывается в пара-аминоазобензол.
Как правило, О-арилазо- и N-арилазосоединения сравнительно неустойчивы, существуют в таутомерном равновесии с парой соответствующих ионов или гидролизуются (особенно в присутствии кислот) с выделением исходных – нуклеофила и соли диазония, которая затем вступает в дальнейшие превращения.
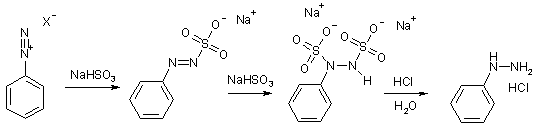
Как электрофилы, соли арилдиазония образуют аддукт с нуклеофилом – гидросульфит-ионом. Это малоустойчивое солеобразное соединение в растворе склонно к присоединению молекулы гидросульфита. Разложение N,N’-дигидросульфитпроизводного при подкислении приводит к образованию арилгидразина; лучшие результаты достигаются при добавлении более мощного восстановителя в кислой среде – цинковой пыли или хлорида олова(II). Эта реакция позволяет синтезировать арилгидразины, которые трудно получить другими методами.
Циклоприсоединение
Диазосоединения алифатического ряда легко вступают в реакции циклоприсоединения в качестве 1,3-диполей. Эта реакция зачастую используется для синтеза гетероциклических соединений – пиразолов и конденсированных гетероциклов, содержащих пиразольное ядро.