Нитросоединения
Свойства алифатических нитросоединений
Восстановление
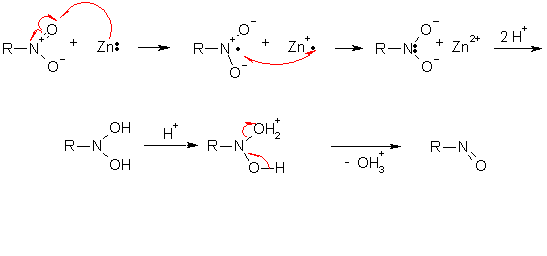
Для нитросоединений, независимо от строения углеродного скелета молекулы, характерны реакции восстановления. В алифатическом ряду эта реакция практически всегда приводит к аминам, хотя в специальных условиях могут быть получены также промежуточные продукты – нитрозоалканы и алкилгидроксиламины.
![]()
Восстановление нитроалканов обычно протекает весьма легко: можно применять довольно мягкие реагенты, например, металлы в кислой среде, соли олова(II), Na2S2O4 и т.д. Механизм этих реакций обычно рассматривают как последовательность актов одноэлектронного переноса от восстановителя к нитрогруппе и последующего присоединения протона.

Кислотность первичных и вторичных нитроалканов
Нитрогруппа, являясь сильным электроноакцептором, способствует поляризации соседних связей (аналогичное явление наблюдается в оксосоединениях). По этой причине нитроалканы, имеющие атомы водорода в α-положении, способны к депротонированию, т.е. первичные и вторичные нитроалканы проявляют СН-кислотность и способность к прототропной таутомерии.
Образующийся при действии оснований сопряженный резонансно стабилизированный анион нитроновой кислоты можно изобразить следующим образом:

| Соединение |
CH3NO2 |
CH3CH2NO2 |
CH2(NO2)2 |
CH(NO2)3 |
| pKa |
10.2 |
8.5 |
4.0 |
»0.0 |
Как видно из величин pKa, нитроалканы депротонируются под действием гидроксид-аниона. Действительно, нитрометан (жидкое вещество тяжелее воды) растворяется в водной щелочи в результате превращения в аци-нитрометанат натрия, при подкислении этого раствора быстро происходит освобождение ацинитроформы, также растворимой в воде. Постепенный переход ацинитроформы в нитросоединение наблюдается по образованию нерастворимого в воде исходного соединения. Это явление называется десмотропией (сильно замедленной таутомерия).

Ацинитрометан можно рассматривать как азотистый аналог енола.
В присутствии сильных кислот ацинитросоединения способны не только превращаться в более стабильную нитроформу, но также претерпевать гидролиз, образуя карбонильное соединение (реакция Нефа).

Способность образовывать ацинитроформу или анион придает нитроалканам свойства С-нуклеофилов средней силы. К превращениям ацинитроформы можно отнести реакцию нитрозирования. Первичные нитроалканы превращаются в нитроловые кислоты, вторичные – в псевдонитролы.

Общепринятый механизм этого превращения подразумевает образование протонированной молекулы HNO2 либо катиона нитрозония (NO+) в качестве электрофила.

Ацинитроалкан способен к конденсации с С-электрофилами, например, формальдегидом.

Взаимодействие нитроалканов с менее активными электрофилами, такими как ароматические альдегиды, проводят в присутствии слабых оснований. При использовании триэтиламина создается достаточно высокая концентрация аниона и реакция идет почти мгновенно. В случае, когда в реакцию вовлекают первичный нитроалкан, практически всегда происходит отщепление молекулы воды от промежуточно возникающей молекулы нитроспирта и образуется более стабильное сопряженное непредельное нитросоединение.

Взаимодействие вторичных нитроалканов с альдегидами завершается образование нитроспирта
