
Алкины
Свойства алкинов
Реакции с участием тройной связи
Гидрирование ацетиленов, как и алкенов, чаще всего проводят в условиях гетерогенного катализа:

Несмотря на то, что первая стадия гидрирования протекает более экзотермично, остановить на ней реакцию затруднительно. Однако созданы особые катализаторы, которые позволяют из алкинов получать алкены.

Как и при каталитическом восстановлении соединений с двойной связью, при гидрировании ацетиленов всегда наблюдается син-присоединение. транс-Алкены образуются в результате восстановления алкинов раствором натрия или лития в жидком аммиаке (до превращения металла в амид).

Алкины присоединяют галогены, галогеноводороды, воду и другие реагенты по электрофильному механизму, однако такие реакции протекают значительно труднее, чем в алкенах. В качестве причин можно привести следующие:
1. Две вырожденные ВЗМО ацетилена (Е = -1088,6 кДж/моль) лежат ниже, чем ВЗМО этилена (Е = -963 кДж/моль).
2. Теплота образования ΔН0f (СН3-СН2+) = 917 кДж/моль
ΔН0f (СН2=СН+) = 1113,7 кДж/моль
Разница составляет 196,7 кДж/моль
3. Энтальпия ионизации в газовой фазе
CH3CH2Cl → СН3-СН2+ + Cl- ΔН0f = 799,7 кДж/моль
CH2=CHCl → CH2=CH+ + Cl- ΔН0f = 933,7 кДж/моль
Разница равна 134,0 кДж/моль
Из приведенных энергетических параметров легко видеть, что образующийся в результате присоединения электрофила к алкину винильный карбокатион более богат энергией (менее стабилен, труднее образуется), чем алкильный катион, возникающий при атаке электрофильной частицы молекулы алкена потому что алкилиденовая группа является более слабым донором, чем алкильная.

Другой способ объяснения заключается в том, что sp-гибридный С-атом со значительно большим трудом отдает электрофилу пару электронов, чем С-атом в состоянии sp2, поскольку вклад s-характера его орбиталей составляет 50%, а не 33%, т.е. электроны лежат ближе к ядру (см. выше энергии ВЗМО).
Отношение скорости реакции бромирования этилена к скорости бромирования ацетилена в уксусной кислоте составляет величину 1,14·104.

Это легко видеть на примере реакции несимметричного субстрата:

Практическое значение имеет присоединение хлора, которое позволяет получать полупродукты органического синтеза и растворители, например тетрахлорэтан.
Хлороводород легко присоединяется к алкинам только в присутствии катализаторов. Так, винилхлорид получают действием HCl на ацетилен в присутствии хлорида ртути (II).

Эта реакция имеет большое практическое значение, т.к. винилхлорид является мономером для получения широко используемого в промышленности материала – поливинилхлорида.

Дальнейшее присоединение хлороводорода к винилхлориду протекает легко и ориентируется в соответствием с правилом Марковникова – образуется 1,1-дихлорэтан, легко гидролизующийся до ацетальдегида

Для описания реакций электрофильного присоединения к алкинам применяют два механизма – би- и тримолекулярный (AdE2 и AdE3).
Бимолекулярное присоединение характерно для арил- и арилалкилацетиленов, которые превращаются в смесь цис- и транс-алкенов.

Далкилацетилены присоединяют по тримолекулярному механизму, в пользу чего свидетельствует стереоселективность реакции.

Присоединение воды к алкинам в присутствии кислот и солей ртути(II) называют реакцией Кучерова. С помощью этого превращения из ацетилена получают ацетальдегид, который может быть окислен до уксусной кислоты. Из замещенных алкинов в этих условиях образуются кетоны (правило Марковникова)
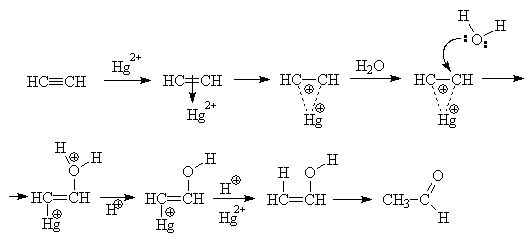
Карбоновые кислоты присоединяются к ацетиленам, образуя сложные эфиры винилового спирта.

Данная реакция, как и присоединение воды, облегчается в присутствии катионов ртути. Последние катализируют также присоединение к ацетиленам других нуклеофилов, например, спиртов, что приводит к алкилвиниловым эфирам.
Однако, эти же соединения образуются, если проводить реакцию не в кислой, но в щелочной среде при повышенной температуре (200 °С) и давлении. В этих условиях алкины присоединяют по нуклеофильному механизму, который для алкенов не совсем характерен


Реакция винилирования демонстрирует электрофильный характер sp-гибридного атома углерода. Важное промышленное значение имеет присоединение HCN приводящее к ценному полупродукту – акрилонитрилу.

Ацетилен и его гомологи под действием высокой температуры (500 °С) и активированного угля претерпевают тримеризацию в производные бензола (реакция Бертло), тогда как при 60 °С в присутствии цианида никеля происходит тетрамеризация с образованием циклооктатетраена.

Окисление ацетиленов
Ацетилены окисляются действием перманганата калия в щелочной среде по месту разрыва тройной связи до карбоновых кислот, в более мягких условиях (OsO4, нейтральная среда) реакция останавливается на стадии образования 1,2-дикарбонильных соединений.
