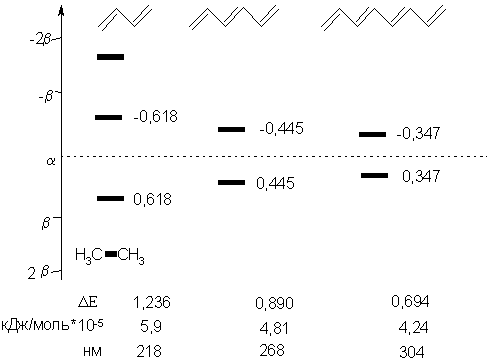Алкадиены
Диенами называются углеводороды, имеющие в молекуле две двойне связи. Различают три типа диенов: изолированные, сопряженные и кумулированные.
![]()
Если между кратными связями в цепи молекулы диена находится хотя бы одна метиленовая группа (СН2), они практически не отличаются по своим свойствам от алкенов и поэтому в данном разделе рассматриваться не будут. Это – так называемые изолированные диены.
Те соединения, в молекулах которых двойные связи разделены одной одинарной связью, называются сопряженными. Они обладают рядом специфических свойств, связанных с сопряжением π-электронных орбиталей.
Кумулированные диены весьма мало изучены, но их строение и свойства представляют значительный интерес.
Сопряженные алкадиены (1,3-диены)
К наиболее известным представителям сопряженных диенов относятся: бутадиен-1,3 (дивинил), 2-метилбутадиен-1,3 (изопрен), 2-хлорбутадиен-1,3 (хлоропрен).

Эти соединения используются в качестве мономеров для промышленного получения различных полимерных материалов, главным образом каучуков. Дивинил получают ступенчатым дегидрированием бутана на оксидном железо-хромовом катализаторе при 550-600 °С.
![]()
В России Лебедевым был предложен способ получения дивинила из этанола

Находит применение способ немецкого химика Реппе, согласно которому бутадиен синтезируют из 1,4-бутиндиола (бис-гидроксиметилацетилена) через стадию 1,4-бутандиола:

Согласно результатам структурных исследований, молекула простейшего представителя этого класса углеводородов – бутадиена-1,3 имеет плоскую геометрию, все четыре атома углерода имеют гибридизацию sp2. Она может находиться в форме двух конформаций, обозначаемых s-цис и s-транс (s от английского "single" – одинарный). Конформации различаются взаимным расположением винильных фрагментов относительно одинарной связи, с чем и связано это обозначение. Барьер вращения вокруг одинарной связи в бутадиене составляет 25 кДж/моль, т.е. значительно выше, чем в этане (13 кДж/моль), но лишь ненамного превосходит разницу энергий заслоненной и заторможенной конформаций бутана (22,6 кДж/моль). s-цис-Конформация на 25 кДж/моль менее выгодна, чем s-транс.

Интересным представляется причина, по которой вращение в молекуле бутадиена затрудненно. Как показывают структурные исследования, в молекуле 1,3-бутадиена двойные связи (135 пм) несколько длиннее, чем в этилене (134 пм), а ординарная связь С2-С3 (146 пм) короче, чем в этане (154 пм). Это заставляет предпожить, что порядок связей в бутадиене не является целочисленным, т.е. π-электронная плотность делокализована с участием четырех С-атомов. Квантово-химические расчеты дают следующие величины порядка π-связей С1-С2 0,894, и С2-С3 –0,447.

Таким образом, можно говорить о частичной двоесвязности атомов углерода в молекуле: связь С2-С3 несколько больше чем одинарная, а связи С1-С2 и С3-С4 несколько меньше, чем двойные. Это явление, называется сопряжением π-связей. Сопряжение возможно благодаря тому, что p-орбитали, которые эти связи образуют, расположены не на линии между ядрами, а в перпендикулярной плоскости, что допускает их перекрывание во всех направлениях. Другими словами, p-орбиталь атома С2 взаимодействует с орбиталями как атома С1, так и С3.
Делокализацию π-электронов можно изобразить разными способами:
1. С помощью набора резонансных структур (следует помнить, что вклад структур с разделенными зарядами в резонансный гибрид обычно меньше, чем тех, в которых заряды не разделены).
![]()
2. Изогнутыми стрелками, показывающими направление смещения электронной плотности, а также частичной двоесвязностью (так называемая мезомерная структура, пунктиром обозначаются связи нецелого порядка)
![]()
О перекрывании двух π-орбиталей через простую σ-связь дает наглядное представление метод молекулярных орбиталей (ЛКАО МО), разработанный физиком Хюккелем. В молекуле бутадиена-1,3 имеется четыре молекулярные π-орбитали (π-МО), получаемые в результате линейной комбинации четырех атомных р-орбиталей. Эти π-МО имеют разные энергетические уровни, расчет которых для каждой орбитали может быть сделан посредством решения уравнения Шредингера (Нy = Еy). В этом уравнении волновая функция МО представлена как линейная сумма волновых функций атомных орбиталей с соответствующими коэффициентами.
Y = с1j1 + с2j2 + с3j3 +с4j4
j – некоторая мера вероятности пребывания электрона в объеме пространства,
с – доля участия атомной орбитали в молекулярной орбитали.
Выше было показано использование метода молекулярных орбиталей Хюккеля (МОХ) для молекулы этилена. Применим этот же метод для расчета сопряженной π-системы бутадиена.
|
|
НСМО |
| ВЗМО |
О наличии сопряжения в молекуле бутадиена-1,3 делают вывод на основании того, что энергия его четырех электронов меньше таковой двух изолированных пар π-электронов в двух молекулах этилена, которая, как было показано, равна 2(α + β):
ΔEπ = (4α + 4β) – (4α + 4,472β) = 0,472β
ΔEπ называют энергией сопряжения или энергией резонанса. Эта величина позволяет оценить стабилизацию системы за счет сопряжения (резонанса).
Две орбитали ВЗМО и НСМО называют фронтальными, и они отвечают за реакционную способность соединения: ВЗМО в реакции с электрофилами, НСМО – с нуклеофилами. Одним из убедительных аргументов, подтверждающих явление делокализации в 1,3-диенах и других сопряженных системах считаются данные электронной спектроскопии этих соединений.
Ультрафиолетовая (УФ) или электронная спектроскопия позволяет определить величину кванта энергии, необходимого для перехода электрона с одного энергетического уровня на другой. Для этого измеряется длина волны, при которой происходит наиболее интенсивное поглощение электромагнитного излучения. Переход любой молекулы из стационарного состояния в возбужденное является следствием поглощения энергии. Наименьшая энергия затрачивается при переходе одного электрона с ВЗМО на орбиталь с более высокой энергией (НСМО). Эта энергия квантована, т.е. конкретному переходу электрона соответствует строго определенная ее величина. Последняя, в свою очередь, имеет эквивалент в виде длины волны, при поглощении которой происходит возбуждение молекулы. Молекулы бесцветных веществ переходят в возбужденное состояние под действием весьма высоких энергий, т.е. поглощают в коротковолновой части электромагнитного спектра.. Они занимают область с длинами волн от 100 до 400 нм, что соответствует энергии от 1170 до 293 кДж/моль. Бóльшую энергию поглощают σ-связи. Так, λmax (длина волны максимального поглощения) алканов лежит в области более коротких, чем 150 нм, волн. Это может быть зафиксировано лишь в условиях глубокого вакуума, т.к. воздух поглощает при длине волны, меньшей 180 нм. Несколько меньшая энергия требуется для возбуждения алкенов, но их область поглощения тоже закрыта воздухом (λmax гексена-3 184 нм, Е = 712 кДж/моль). Соединения же с сопряженными связями поглощают ультрафиолет в доступной для наблюдения части спектра (λmax бутадиена-1,3 217 нм, Е = 540 кДж/моль). С увеличением длины сопряжения максимум поглощения смещается в более длинноволновую область (λmax гексатриена-1,3,5 255 нм, Е = 452 кДж/моль; декатетраена-2,4,6,8 310 нм, Е = 389кДж/моль). Для того, чтобы понять причины этого явления вернемся к рассмотрению молекулярных орбиталей этилена и сопряженных полиенов.

Легко видеть, что энергия ВЗМО этилена α+β (-10,88*10-5 кДж/моль) меньше, чем энергия сопряженной системы бутадиена-1,3, которая имеет величину α+0,618β (-9,43*10-5 кДж/моль). Обратное соотношение имеют энергии НСМО этих молекул. Таким образом, с увеличением длины сопряжения разница энергий НСМО и ВЗМО «ΔЕ» уменьшается. Это означает: возбуждение сопряженных систем требует меньшую энергию, чем несопряженных. Следовательно, в бутадиене-1,3-имеется сопряжение.