Алкены
Свойства алкенов
Окисление и восстановление алкенов
Как и предельные углеводороды, алкены при высокой температуре окисляются (горение) до углекислого газа и воды. Окисление этилена кислородом воздуха в присутствии серебра под давлением приводит к получению кислородсодержащего аналога циклопропана – этиленоксида, являющегося важным реагентом как для промышленных, так и для лабораторных синтезов.
![]()
Перманганат калия в водном растворе на холоду превращает алкены в 1,2-алкандиолы, или гликоли (реакция Вагнера).
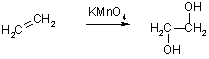
Механизм этого превращения представляют как присоединение перманганат-аниона в двойной связи алкена с образованием циклического эфира и его последующий гидролиз.
При действии хромового ангидрида происходит расщепление алкенов по двойной связи с образованием карбонильных соединений (если при этом получаются альдегиды, то они окисляются до соответствующих карбоновых кислот).
Промышленное значение имеют реакции окисления алкенов надбензойной кислотой (реактив Прилежаева) с образованием эпоксисоединений, а также хлоридом платины(II) до ацетальдегида (Вакер-процесс).
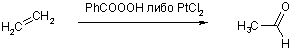
Восстановление алкенов протекает весьма трудно: так, атомарный водород в момент выделения с алкенами не реагирует. Для гидрирования алкенов необходимо использование металлического (Ni, Pt, Pd) катализатора, способного адсорбировать водород на поверхности, что позволяет получить соответствующие алканы. Данная реакция сильно экзотермична. Выделяющуюся энергию называют теплотой гидрирования и ее величина для различных алкенов составляет около 120 кДж/моль (мера устойчивости алкенов).
Теплотой гидрирования алкенов называют количество тепла, выделяющееся при восстановлении одного моля алкена. Этот параметр характеризует устойчивость непредельных соединений: чем больше теплота гидрирования, тем большей энергией и меньшей устойчивостью обладает восстанавливаемая кратная связь.
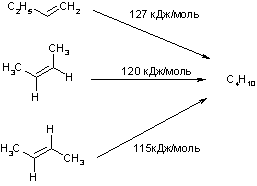
Из приведенной схемы видно, что стабилизации алкенов способствуют наличие заместителей при кратной связи и транс-конфигурация
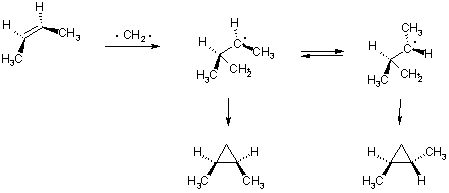
Кроме катионов и радикалов к алкенам присоединяются также карбены, при этом образуются производные циклопропана. Это превращение относится к реакциям 1,2-циклоприсоединения.
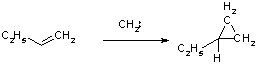
Карбенами называют нейтральные двухвалентные углеродсодержащие частицы, имеющие два электрона, которые они используют для образования связи с реагентом. Атом углерода в карбене имеет 4 электрона на внешнем уровне. Два электрона, не участвующие в образовании связей, могут занимать либо одну орбиталь, имея антипараллельные спины (синглетный карбен), либо, распариваясь, располагаются с параллельными спинами на двух орбиталях (триплетный карбен). Если синглетный карбен является частицей с неподеленной электронной парой, то триплетный является по сути бирадикалом.
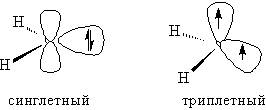
При взаимодействии с окружающими молекулами синглетный карбен отдает им честь энергии и превращается в более устойчивый триплетный. Поэтому реакции алкенов с синглетным карбеном проводят в растворе, где в силу высокой концентрации непредельного соединения реакция идет быстрее, чем переход карбена в триплетное состояние. Напротив, реакции триплетного карбена проводят в газовой фазе, создав низкую концентрацию реагентов, при которой синглетный карбен успевает перейти в триплетное состояние и лишь после этого вступить во взаимодействие с алкеном.
Стереохимия присоединения обеих форм карбенов к алкенам различна. Синглетный метилен присоединяется к бутену-2 стереоспецифично: из цис-бутена образуется цис-диметилциклопропан, из транс- ¾ транс-изомер. Данная реакция идет через трехчленный активированный комплекс, в котором происходит синхронное перемещение электронов (одностадийно).
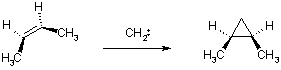
В отличие от синглетного, присоединение триплетного карбена имеет ступенчатый механизм. В результате присоединения карбена к одному из sp2-гибридных атомов образуется бирадикальный интермедиат, в котором возможно свободное вращение вокруг σ-связи между атомами углерода. Образование цикла возможно только после инверсии спина неспаренного электрона, поэтому реакция нестереоспецифична.