Алкены
Свойства алкенов
Электрофильное присоединение (AdE)
Максимум электронной плотности π-связи расположен вне оси, соединяющей ядра атомов, в связи с чем π-электроны оказываются доступными для реагентов, имеющих электрофильный (кислоты Льюиса) или радикальный характер. Поэтому для алкенов характерны реакции присоединения Ade. Эти реакции могут протекать с одновременным участием двух (Ade-2-реакция) или трех частиц (Ade-3-реакция).
Для гомолитического разрыва одной из этиленовых связей требуется 260 кДж/моль, т.е. на 91 кДж/моль меньше, чем необходимо для гомолиза ординарной С-С-связи. Не лишена оснований точка зрения, согласно которой двойная связь состоит из двух неэквивалентных связей, причем σ-связь более энергонасыщена, прочнее, чем π-связь. Другой вариант объяснения предполагает, что обе связи эквивалентны, и при разрыве одной из них появляется выигрыш энергии, равный 91 кДж/моль, т.к. одновременно с разрывом π-связи происходит изменение типа гибридизации обоих С-атомов, их переход в более стабильное sp3-состояние.
Рассмотрим бромирование этилена, как самый простой пример реакций присоединения.
Механизм реакция, на первый взгляд, может быть синхронным присоединением молекулы брома к молекуле этилена.

Однако есть, по крайней мере, два факта, которые заставляют предположить более сложный механизм процесса.
Во-первых, бромирование олефинов в насыщенном спиртовом растворе хлорида лития приводит к образованию 1-бром-2-хлоралканов, например
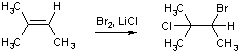
Во-вторых, присоединение брома к циклическим алкенам протекает стереоселективно – образуются в основном транс-дигалогенциклоалканы.
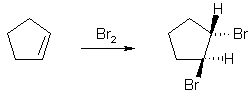
Эти факты могут быть объяснены только двухстадийным механизмом реакции.
На первой стадии, при сближении реагентов молекула брома поляризуется, возникает т.наз. π-комплекс, в котором электронная плотность π-связи этилена смещена в направлении молекулы брома (или другого электрофила). Образовавшийся π-комплекс затем превращатся в σ-комплекс, т.е. за счет электронов разорвавшейся π-связи возникает ковалентная связь C-Br. Орбиталь с одной из неподеленных электронных пар брома перекрывается с вакантной орбиталью атома углерода образовавшегося карбатиона, что дает циклический катион бромония.
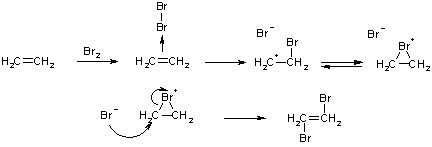
Далее, освободившийся бромид-ион атакует катион бромония, и одновременно с этим происходит разрыв одной связи в цикле. Присоединение аниона возможно только с тыла, т.к. в противном случае возникает сильное отталкивание электронных оболочек атомов галогена.
Аналогично происходит присоединение к алкенам и других электрофильных реагентов: галогеноводородов, воды (в присутствии серной кислоты). На первой стадии в этих реакциях электрофил (протон) атакует молекулу олефина, превращая ее в карбокатион, который затем реагирует с нуклеофилом (галогенид-ион, вода).
Присоединение этих реагентов к несимметричным алкенам идет региоселективно и подчиняется правилу Марковникова, которое заключается в том, что протон присоединяется к наименее замещенному атому углерода. Такую ориентацию реакции объясняют относительной устойчивостью промежуточных карбокатионов. Если присоединение протона к пропилену происходит по положению 2, то образуется первичный карбкатион, если по положению 1 – то вторичный. Ввиду того, что вторичные катионы стабильнее первичных, то реакция идет в основном по второму пути.

Сильные электроноакцепторные заместители, особенно мезомерные акцепторы оказывают такое влияние на двойную связь, что присоединение идет против правила Марковникова.
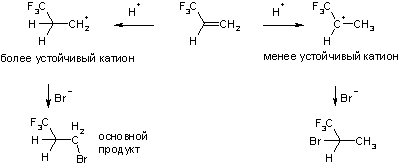
Реакции несимметричных реагентов с такими алкенами идут зачастую как нуклеофильное присоединение, т.е. на первой стадии реагирует отрицательно-заряженная частица, которая, соответственно, атакует положительно заряженный атом.
Среди превращений алкенов, для которых постулируется промежуточное возникновение карбокатионов, отметим реакции димеризации, например, изобутилена.
Данный синтез лежит в основе получения изооктана, используемого в качестве авиационного топлива.
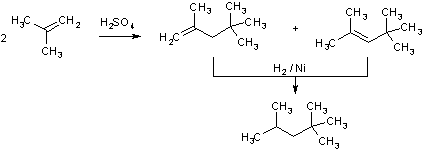
Считают, что при действии на изобутилен 60%-ным раствором серной кислоты сначала протон присоединяется к алкену, образовавшийся трет-бутиловый карбокатион реагирует с исходным изобутиленом и образуется новый третичный карбокатион. Такой процесс наращивания цепи гипотетически мог бы продолжаться и далее, что привело бы к полимерным продуктам, но в условиях реакции образуется вода, которая разбавляет кислоту и снижает тем самым ее протонирующую способность. Поэтому карбокатион отдает протон воде и стабилизируется таким путем в два изомерных олефина.
Для получения изооктана смесь полученных алкенов гидрируют на никелевом катализаторе.
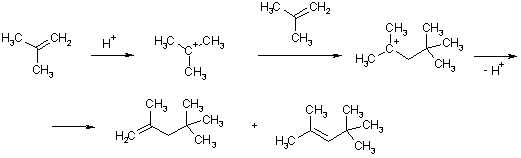
Для понимания свойств карбокатионов значительный интерес представляет следующее превращение:

Присоединение хлороводорода к 3,3-диметилбутену-2 происходит с образованием двух изомерных хлоралканов. Это объясняют тем, что возникающий в результате атаки протона вторичный карбокатион перегруппировывается в более устойчивый третичный катион путем миграции (1-2) метильной группы.
Это еще одно важное свойство карбкатионов – способность к внутримолекулярным перегруппировкам, которые происходят путем сдвига атома водорода или алкильного заместителя и обусловлены термодинамической стабилизацией катиона
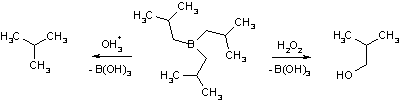
По электрофильному механизму протекает также гидроборирование алкенов. Несмотря на то, что бор имеет электроотрицательность, равную 2,0, диборан (B2H6) проявляет свойства электрофила (кислоты Льюиса), т.к. атом бора имеет незаполненную р-орбиталь. Благодаря этому гидрид бора легко реагирует с соединениями, обладающими избыточной электронной плотностью (основания Льюиса). Так, в эфирном растворе он образует комплексное соединение.
При взаимодействии с алкенами гидрид бора последовательно присоединяет три молекулы алкена.
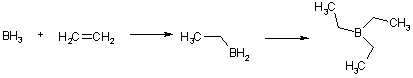
С несимметрично замещенными алкенами образуются продукты по правилу Марковникова, т.е. бор, как электрофил, присоединяется к концевому атому углерода. Молекулы алкилборанов имеют плоскую конфигурацию. Последующий гидролиз алкилборанов может быть использован в качестве альтернативного метода синтеза алканов, а окисление в щелочной среде позволяет получить спирты. Последняя реакция весьма важна, т.к., в отличие от прямой гидратации, в случае алкенов сложного строения, приводит к первичным спиртам.