
Алкены
Номенклатура и изомерия алкенов
Алкены образуют гомологический ряд соединений с общей формулой CnH2n. В отличие от алканов, физические свойства алкенов сильнее зависят от структуры углеродного скелета, а также от расположения двойной связи.
Названия алкенов по номенклатуре ИЮПАК образуют путем замены окончания -ан в названии соответствующего предельного углеводорода окончанием -ен. Этан – этен, пропан – пропен. Начиная с третьего представителя ряда алкенов начинает проявляться изомерия: структурная и геометрическая. Геометрическая изомерия алкенов связана с тем, что свободный поворот вокруг двойной связи невозможен, если молекула находится в основном состоянии (см. главу Стереохимия). Например, бутен существует в виде нескольких изомеров: бутен-1, цис-бутен-2 (Т. пл. -139 °С, Т. кип. 4 °С) и транс-бутен-2 (Т. пл. -106 °С, Т. кип. 1 °С), 2-метилпропен. Приставки цис- и транс- означают, по одну или по разные стороны от кратной связи находятся заместители. Зачастую используют тривиальные названия: бутилен, изобутилен.

Если в молекуле бутена-2 имеется более двух заместителей, то приставки цис- и транс- не позволят дать однозначного названия соединению. Для того, чтобы этого избежать, указывают взаимное расположение наиболее старших заместителей. Изомеры в этом случае обозначают Z- (старшие по одну сторону) и E- (наоборот). Определение старшинства заместителей производят по тем же правилам, что и в S-R-номенклатуре хиральных соединений (см. тему "Стереохимия"). Например, геометрические изомеры хлорбромпропенов называют следующим образом:
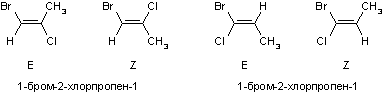
Названия непредельных радикалов, как и алкильных, по ИЮПАК образуют путем прибавления окончания -ил к названию алкена, но иногда применяют и тривиальные названия:
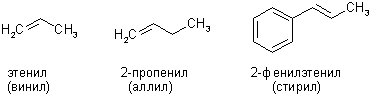
Образование кратной связи без изменения углеродного скелета.
Дегидрирование алканов осуществляется, чаще всего, путем нагревания в присутствии таких катализаторов, как аморфный палладий (либо палладий на угле), платиновая чернь или скелетный никель (никель Ренея). В этом ряду активность катализаторов снижается, однако, снижается и их стоимость.
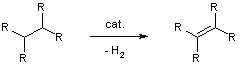
В промышленных масштабах в качестве катализаторов часто применяют смешанные оксиды хрома и железа (Cr2O7 / Fe2O3) при 500-600 °С. Для получения этилена этан дегидрируют на нихроме при 800 °С.
Другим промышленным методом получения этана является термическая переработка нефти (крекинг). Каталитический крекинг заключается пропускании паров тяжелых алканов через нагретую до 450 °С трубку с алюмосиликатным стеклом. При этом происходит расщепление молекулы с образованием алканов меньшей молекулярной массы, алкенов и водорода.
Нужно отметить, что реакции дегидрирования, в отличие от гидрирования, способствует повышенная температура. Скорее всего, это связано с тем, что решающую роль в смещении равновесия здесь играет энтропийный фактор. На легкость реакции существенное влияние оказывает структура исходного алкана: более разветвленные алканы дегидрируются легче, чем нормальные, наиболее легко реакция протекает в случае циклоалканов. Дегидрирование является обратимой реакцией, поэтому легче всего получаются наиболее стабильные, максимально замещенные алкены.
Вместе с тем, дегидрирование алканов не имеет широкого применения в лаборатории, т.к. требует весьма жестких условий и дает зачастую сложные смеси продуктов.
Большинство важнейших лабораторных методов получения алкенов основано на реакциях элиминирования, в основном, какой-либо кислоты из алифатической молекулы под действием основания.
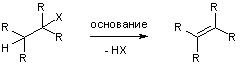
Наиболее широко изучены два механизма элиминирования – Е2 и Е1, причем первый встречается чаще.
Почти во всех случаях реакции отщепления конкурируют с реакциями нуклеофильного замещения. Реакции Е1 сопровождаются реакциями SN1, а реакции Е2 конкурируют с реакциями бимолекулярного замещения, т.е. реакциями типа SN2. На относительную скорость реакций отщепления и замещения важную роль оказывают такие факторы, как структура субстрата, природа уходящей группы и атакующего основания.
Чаще всего химики прибегают к реакциям отщепления молекулы галогеноводорода от иод-, хлор- и бромалканов. Алкилфториды, по большей части, в этой реакции малоактивны либо инертны. Кроме этих соединений, зачастую используются также сульфонаты, третичные тиониевые и четвертичные аммониевые соли.
Структура субстрата влияет на скорость элиминирования следующим образом: в наибольшей степени отщеплению подвержены третичные галогеналканы, в наименьшей – первичные. Вторичные занимают промежуточное положение. Например, при обработке трет-бутилхлорида концентрированной щелочью основным продуктом становится не трет-бутиловый спирт, а изобутилен.
Для того, чтобы провести преимущественно реакцию отщепления, необходимо использовать нуклеофил, обладающий низкой поляризуемостью и высокой основностью. Для скорости реакций типа Е2 наблюдается следующая последовательность: NH2- > C2H5O- > OH- > CH3COO- > Hal-. Другими словами, при использовании в качестве основания ацетат- и галогенид-ионов мы, скорее всего, получим не продукт элиминирования, но продукт замещения.
Кроме того, реакциям элиминирования, по сравнению с реакциями замещения, способствует повышенная температура.
На практике для проведения таких реакций чаще всего используются такие реагенты, как КОН или этилат калия в этиловом спирте.
Региоселективность реакций элиминирования
Как правило, при отщеплении от несимметрично замещенных алкилгалогенидов образуются алкены с наиболее возможным числом заместителей при кратной связи. Эта закономерность известна как правило Зайцева. Например, 2-хлор-2-метилбутан под действием NaOH дает 86% 2-метилбутена-2 и 14% 2-метилбутена-1.
Однако, состав продуктов отщепления зависит от природы уходящей группы, например, реакция 2-замещенных пентанов CH3-CHX-CH2-CH2-CH3 с этилатом калия в спирте дает следеющие соотношения замещенных олефинов:
| X |
пентен-1 |
пентен-2 |
| -Br |
31 |
69 |
| -I |
30 |
70 |
| OSO2R |
48 |
52 |
| -S+(CH3)2 |
87 |
13 |
| -N+(CH3)3 |
98 |
2 |
В тех случаях, когда в результате элиминирования преобладает терминальный олефин, реакцию называют отщеплением по Гофману.
На соотношении продуктов сказывается также природа атакующего основания и если речь идет об алкоголятах, то их размер. Например, при реакции 2-бром-2-метилбутана с алкоголятами калия
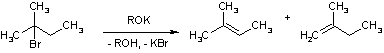
получаются следующие смеси:
| RO- |
2-метилбутен-2 |
2-метилбутен-1 |
| EtO- |
70 |
30 |
| t-BuO- |
27.5 |
72.5 |
| EtMe2CO- |
22.5 |
77.5 |
| Et3CO- |
11.5 |
88.5 |
Стереохимия реакций Е2 такова, что в подавляющем большинстве случаев основной продукт – это транс-алкен, что связано с механизмом реакции. Чаще всего имеет место более выгодное термодинамически транс-элиминирование. Цис-элиминирование встречается реже, например, при термолизе N-оксидов третичных аминов.
К реакциям элиминирования в кислой среде в первую очередь относится дегидратация спиртов. Процесс проводят в присутствии водоотнимающих агентов кислого характера при высокой температуре. В промышленности часто используют раскаленную окись алюминия, тогда как в лабораторных условиях более удобны серная и полифосфорная кислоты при 150-200 °С.
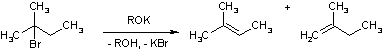
Отметим, что данная реакция неприменима к спиртам с разветвленным радикалом, т.к. в этом случае наблюдаются перегруппировки углеводородного скелета молекулы, а также полимеризация.
Алкены могут быть с хорошими выходами получены путем восстановление виц-дигалогенидов, чаще всего, цинком. Однако эту реакцию правильнее рассматривать как удаление защиты кратной связи, т.к. сами 1,2-дигалогеналканы чаще всего получаются из алкенов.
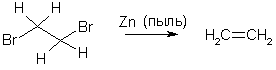
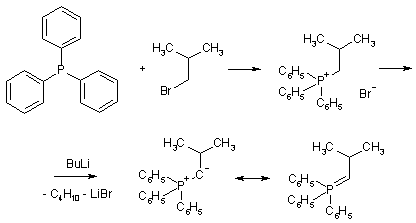
Другие лабораторные методы синтеза алкенов представляют собой реакции, сопровождающиеся изменением углеродного скелета молекулы. Важное место среди них занимает реакция Виттига, состоящая в конденсации карбонильных соединений с илидами фосфора.
Альтернативой реакции Виттига стала недавно открытая реакция каталитического олефинирования – разложение гидразонов в присутствии дигалогеналканов и солей одновалентной меди.
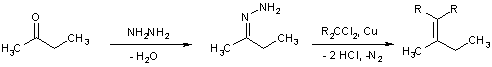
Разумеется, к методам получения алкенов стоит отнести всевозможные конденсации карбонильных соединений с СН-кислотами, такие как реакции альдольно-кротоновой конденсации, синтезы халконов, стирилов, нитростиролов, реакции Перкина и Кневенагеля, которые рассматриваются в главе Альдегиды и кетоны.