Стереоизомерия
Стереохимия – учение о пространственных свойствах молекул; она изучает пространственное (трехмерное) строение молекул и его влияние на их физические и химические свойства, характер и механизм протекания химических процессов. В стереохимии можно выделить три основных раздела: 1) статическая или конфигурационная стереохимия – изучает пространственное строение молекул и его влияние на их физические и химические свойства вещества; 2) конформационный анализ – изучает зависимость физических и химических свойств от конформационного состояния молекул; 3) динамическая стереохимия – изучает стерический ход химических процессов (влияние пространственной структуры реагирующих веществ на направление реакций или зависимость между пространственной структурой продуктов реакции и ее механизмом).
Под термином "пространственное строение" подразумевают расположение в пространстве ядер атомов, составляющих молекулу. Положение же электронов (т.е. распределение электронной плотности в молекуле) называют электронным строением. Очевидно, что пространственное и электронное строение молекулы тесно взаимосвязаны: при изменении электронных эффектов меняется положение ядер и наоборот, геометрические напряжения могут существенно повлиять на распределение электронной плотности.
Пространственное строение органических соединений связано, прежде всего, со стереохимическими особенностями атома углерода, которые зависят, в свою очередь, от его валентного состояния (типа гибридизации).
Для соединений, содержащих только sp3-гибридные атомы углерода характерны, прежде всего, конформационные явления. Если в молекуле присутствуют асимметрические sp3-гибридные атомы углерода (атомы углерода, соединенные с четырьмя различными заместителями), то имеет место энантиомерия и σ-диастереомерия. Указанные стереохимические явления присутствуют и в молекулах, содержащих атомы углерода с иным типом гибридизации.
sp2-Гибридизация создает возможность для появления геометрической изомерии, иначе называемой π-диастереомерией.
Для соединений, содержащих sp-гибридные атомы углерода в основном рассматривают явления динамической стереохимии – стереохимические особенности присоединения к тройной связи или, напротив, стереохимию реакций, приводящих к образованию тройной связи.
Характерной особенностью σ-связей является то, что электронная плотность в них распределена симметрично относительно оси, соединяющей ядра связываемых атомов (цилиндрическая или вращательная симметрия). Поэтому вращение атомов вокруг σ-связи не будет приводить к ее разрыву. В результате внутримолекулярного вращения по σ-связям С–С молекулы алканов, начиная с этана С2Н6, могут принимать разные геометрические формы.
Любое относительное положение совокупности атомов молекулы в пространстве, которое может быть достигнуто без нарушения целостности молекулы называют конформациями.
Конформации молекулы представляют собой энергетически неравноценные ее состояния. Их взаимопревращение происходит быстро и постоянно в результате теплового движения. Поэтому поворотные изомеры не удается выделить в индивидуальном виде, но их существование доказано физическими методами. Некоторые конформации более устойчивы (энергетически выгодны) и молекула пребывает в таких состояниях более длительное время.
Способы графического изображения и номенклатура конформаций
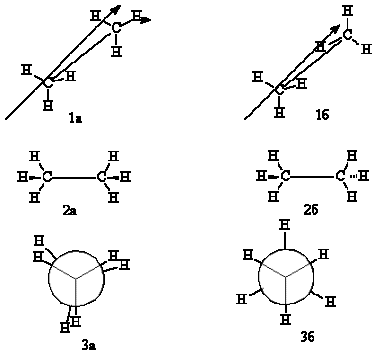
Рассмотрение начнем с молекулы этана. Для нее можно предвидеть существование двух максимально различающихся по энергии конформаций. Они изображены ниже в виде перспективных проекций (1) ("лесопильные козлы"), боковых проекций (2) и формул Ньюмена (3). Эти поворотные изомеры этана отличаются расстояниями между атомами водорода, соединенными с разными атомами углерода.

В перспективной проекции (1а, 1б) связь С-С надо представить себе уходящей вдаль; стоящий слева углеродный атом приближен к наблюдателю, стоящий справа – удален от него.
В боковой проекции (2а, 2б) четыре Н-атома лежат в плоскости чертежа; атомы углерода на самом деле несколько выходят из этой плоскости, но обычно упрощенно считают их также лежащими в плоскости чертежа. "Жирные" клиновидные связи утолщением клина показывают на выход заместителя из плоскости по направлению к наблюдателю того атома, к которому обращено утолщение. Пунктирные клиновидные связи отмечают удаление от наблюдателя.
В проекции Ньюмена (3а, 3б) молекулу рассматривают вдоль связи С-С (в направлении, указанном стрелкой на формулах 1а,б). Три линии, расходящиеся под углом 120° из центра круга, обозначают связи ближайшего к наблюдателю углеродного атома, а концы линий, показывающиеся из-за круга, обозначают связи более удаленного углеродного атома.
Для молекулы этана можно видеть существование двух максимально различающихся по энергии конформаций. Изображенную слева конформацию (1а, 2а, 3а) называют заслоненной, потому что атомы водорода обеих СН3-групп находятся друг против друга. Заслоненная конформация имеет повышенную внутреннюю энергию из-за отталкивания заместителей, и поэтому невыгодна. Конформацию, изображенную справа (1б, 2б, 3б), называют заторможенной, подразумевая, что свободное вращение вокруг связи С-С "тормозится" в этом положении, т.е. молекула существует преимущественно в этой, более выгодной, конформации.
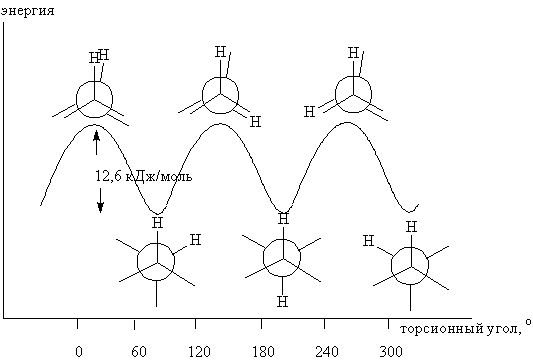
Минимум энергии, необходимый для полного поворота фрагмента молекулы вокруг определенной связи называется барьером вращения для данной связи. Барьер вращения в молекуле, подобной этану, может быть выражен через изменение потенциальной энергии молекулы как функции изменения двугранного (торсионного) угла системы. Двугранный угол (обозначаемый символами τ, Θ или φ) изображен на рисунке, приведенном ниже:

На графике, изображающим энергетический профиль вращения вокруг связи С–С в этане, вращение одного из атомов углерода изображено изменением двугранного угла между двумя выделенными атомами водорода. Барьер вращения, разделяющий две конформации этана, составляет 12,6 кДж/моль, причем минимумы кривой потенциальной энергии соответствуют заторможенным конформациям, максимумы – заслоненным. Поскольку при комнатной температуре энергия столкновений молекул может достигать 80 кДж/моль, то этот потенциальный барьер легко преодолевается, и вращение в этане рассматривают как свободное.