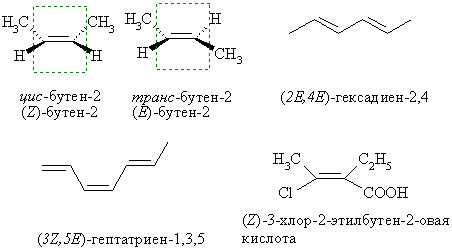
Стереоизомерия
π-Диастереомеры (геометрические изомеры)
Простейший пример существования π-диастереомеров – цис- и транс-бутены. Если два одинаковых заместителя находятся по одну сторону плоскости сравнения – это цис- изомер, если по разные – транс. В более сложных случаях применяют EZ номенклатуру. В этом случае, если два старших заместителя (старшинство определяется по системе Кана-Ингольда-Прелога) из каждой пары находятся по одну сторону плоскости сравнения – это Z-изомер (от немецкого zusammen – вместе), если по разные сторону – Е-изомер (entgegen – напротив).

π-Диастереомеры циклических молекул
1,2-Замещенные циклопропаны, 1,2- и 1,3-замещенные циклобутаны существуют в виде устойчивых π-диастереомеров (цис-транс-изомеров). Плоскость сравнения в этом случае совпадает с плоскостью цикла. Например, 1,2-циклопрпандикарбоновые кислоты существуют в виде двух геометрических цис-транс-изомеров, при этом транс-изомер образует пару энантиомеров. цис-изомер при этом можно рассматривать как мезо-форму, в которой имеется плоскость симметрии, проходящая через метиленовую группу перпендикулярно плоскости цикла.
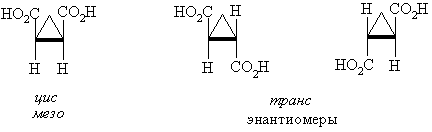
Подобная ситуация наблюдается и в 1,2-дизамещенных циклобутанах. 1,3-Дизамещенные циклобутаны (как цис- , так и транс) не имеют стереогенных центров и не обладают оптической активностью.
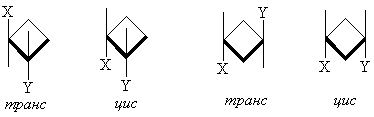
Если заместителей более двух, то применяются следующие правила номенклатуры: опорному (реперному) заместителю присваивается префикс r-, а положения других заместителей относительно опорного обозначаются префиксами с- (цис) и t- (транс). Опорным заместителем выбирается заместитель при атоме углерода с самым низким номером. Даже если реперный заместитель выбран неправильно, само использование префиксов r, c, t гарантирует, что стереохимия соединения отражена правильно.
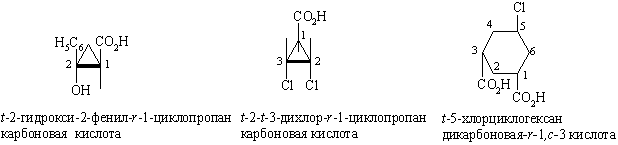
В неплоских циклах с большим, чем 4 числом атомов (циклопентан, циклогексан и т.д.) цис-транс-изомерия тесно связана с конформационными переходами. Так, цис-1,4-дизамещенные циклогексаны существуют в виде эквимолярной смеси двух неразличимых конформеров. Транс-1,4-дизамещенные циклогексаны – в виде смеси е,е-конформера и а,а-конформера с преобладанием первого. Подобная картина наблюдается и для геометрических изомеров 1,2-дизамещенных циклогексанов.
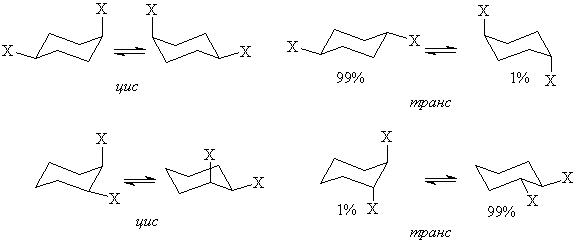
цис- и транс-1,3-дизамещенные циклогексаны существуют в единственной конформации.
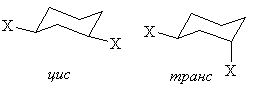
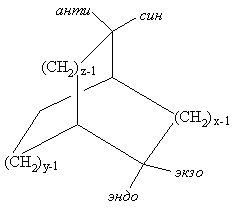
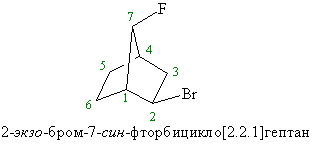
Эндо-экзо и син-анти номенклатура применяется в бициклических системах общей формулы бицикло[x.y.z]алкан, где x ³ y³ z ³ 0. Если заместитель в x или y мостике направлен к z мостику, его обозначают как экзо, если от z мостика, то эндо. Если заместитель в z мостике направлен к х мостику, его обозначают как син, если к у мостику, то анти.
Определение конфигурации π-диастереомеров можно осуществить физическими или химическими методами. Химические методы (исторически более ранние) можно разделить на три типа – абсолютные методы, методы корреляции и направленный диастереоселективный синтез.
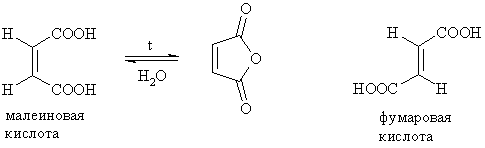
Абсолютные методы заключаются в том, что функциональные группы, находящиеся в цис-положениях относительно друг друга можно превратить в циклические соединения. Например, малеиновая кислота в отличие от фумаровой при нагревании дает малеиновый ангидрид:
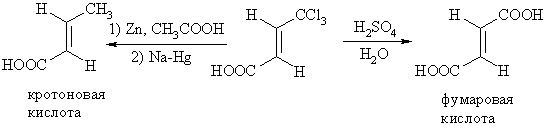
Методы корреляции, не затрагивающие конфигурацию двойной связи заключаются в превращении вещества с неизвестной конфигурацией в вещество с известной конфигурацией. Например, корреляция Е-кротоновой кислоты с фумаровой кислотой:
Направленный стереоселективный синтез – синтез, в котором преимущественно образуется один из геометрических изомеров.
Так, диастереоселективно протекают реакции нуклеофильного присоединения к алкинам. Механизм присоединения осуществляется как анти-присоединение, поэтому всегда образуются Z-алкены.
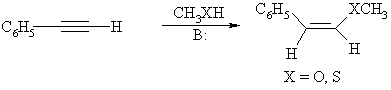
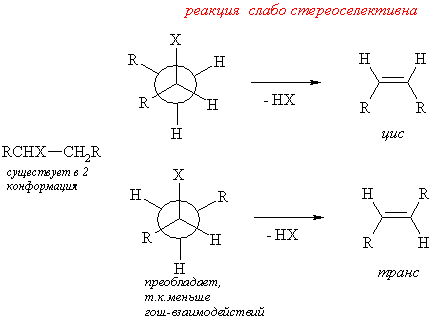
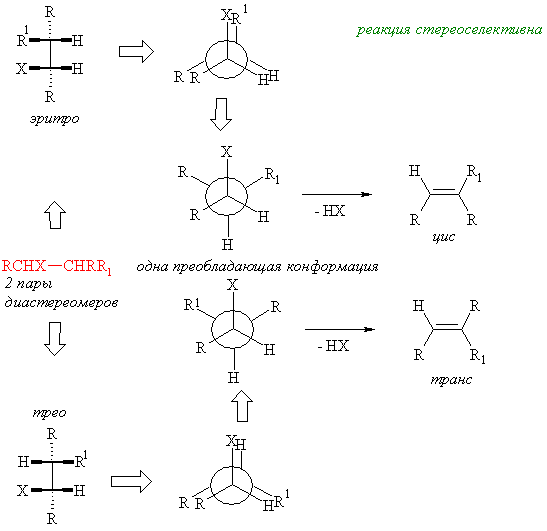
Реакции β-элиминирования в галогеналканах, спиртах или четверичных аммониевых солях (Гофман) протекают как анти-элиминирование. Т.е. атом водорода и уходящая группа отщепляются с противоположных сторон образующейся двойной связи. Т.о. зная преимущественную конформацию исходного вещества можно предсказать стереохимию алкена. Эти реакции являются стереоселективными, но не стереоспецифичными, т.к. элиминирование, как правило, протекает по нескольким направлениям (правило Зайцева, правило Гофмана) – образуются изомеры с различным положением двойной связи.
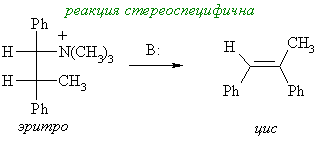
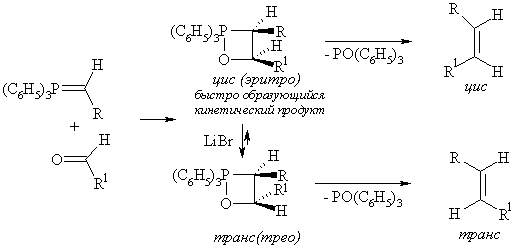
Реакция Виттига становится стереоселективной в строго контролируемых условиях. Например:
Определение конфигурации π-диастереомеров
Различные физические методы можно использовать для определения конфигурации π-диастереомеров.
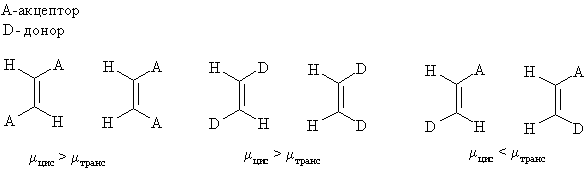
Дипольные моменты. Если молекула алкена содержит полярные группы, то дипольные моменты цис- и транс-изомеров будут существенно отличаться.
| Соединение |
μцис, D |
μтранс, D |
Ткип (цис),°С |
Ткип (транс), °С |
| СHCl=CHCl |
1,15 |
0 |
60,3 |
47,4 |
| CH3CH=CHCH3 |
0,25 |
0 |
3,7 |
0,9 |
| CH3CH=CHCN |
4,08 |
4,53 |
108 |
122 |
Плотность, показатель преломления и температура кипения. "Дипольное" правило – изомер с большим диполем обладает меньшим молярным объемом, предположительно из-за того, что более полярные молекулы благодаря электростатическому притяжению более склонны к самоассоциации. Следовательно более полярные молекулы будут обладать большей плотностью, показателем преломления и температурой кипения (см. таблицу).
ИК спектры. Для того чтобы молекулярное колебание сопровождалось поглощением в ИК спектре, оно должно сопровождаться изменением дипольного момента молекулы.
Так, в ИК спектрах транс-1,2-дихлорэтилена, фумаровой кислоты и транс-3-гексена (для всех дипольный момент = 0) отсутствуют полосы валентного колебания С=С в области 1600 см-1. В соответствующих цис-изомерах эти полосы наблюдаются. В несимметричных молекулах, в которых дипольный момент не равен 0 как в цис-, так и в транс-изомерах наблюдается изменение интенсивности полосы С=С прямо пропорциональное изменению дипольного момента изомеров.
Спектроскопия ЯМР. Для установления конфигурации π-диастереомеров могут быть полезны как хим.сдвиги, так и константы спин-спинового взаимодействия. Для вычисления хим.сдвига СН протона в соединениях общей формулы RCH=CR'R'' пользуются формулой
dС=СН = 5.25 +Zгем + Zцис + Zтранс
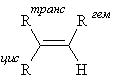
Различия в хим.сдвигах
рассчитанные и экспериментальные
совпадают в пределах 0.2-0.3 м.д. Разница в хим.
сдвигах
цис- и транс-протонов = 0.5 м.д.
считается достаточной для установления
конфигурации с вероятностью 99 %.
| Заместитель |
Zгем |
Zцис |
Zтранс |
| Н |
0 |
0 |
0 |
| Алкил |
0.45 |
-0.22 |
-0.28 |
| Арил |
1.38 |
0.36 |
-0.07 |
| Хлор |
1.08 |
0.18 |
0.13 |
| С=С сопряженная |
1.24 |
0.02 |
-0.05 |
| Формил |
1.02 |
0.95 |
1.17 |
| СО2Н сопряженная |
0.97 |
1.01 |
0.46 |
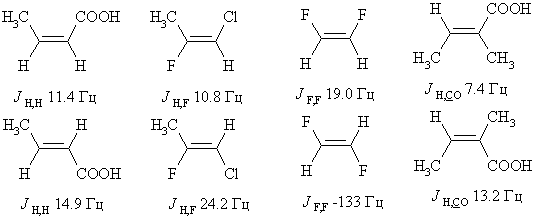
Существенно различаются константы спин-спинового
взаимодействия ядер в
цис- и транс- изомерах. Например:
Ядерный эффект Оверхаузера, заключающийся в том, что при облучении некоторого ядра увеличивается интенсивность сигналов находящихся поблизости ядер, также активно используется для определения конфигурации π-диастереомеров. Так, в β,β-диметилакриловой кислоте (СН3)2С=СНСО2Н облучение протонов одной из метильных групп ведет к увеличению сигнала СН, а облучение другой – нет. Т.е. первая находится в цис-положении относительно СН протона.