Алканы
Наиболее простыми органическими соединениями являются предельные углеводороды или алканы. В соответствии с названием, их молекулы состоят из атомов углерода, образующих скелет, и атомов водорода. Углеродный скелет представляет собой открытую линейную ("нормальные" алканы) или разветвленную цепь. В молекулах этих соединений все атомы углерода имеют максимальную валентность, равную четырем, поэтому их называют предельными, или насыщенными. Таким образом, в алканах реализуются только одинарные σ-связи. Алканы образуют гомологический ряд, и формула любого члена этого ряда имеет вид CnH2n+2.
Гомологический ряд – это бесконечный ряд сходных по строению соединений, причем рядом стоящие представители этого ряда отличаются друг от друга на нефункциональную группу, которая мало влияет на свойства соединений. Она называется гомологической разностью (чаще всего это, как в алканах, группа СН2). Все представители гомологического ряда обладают сходными химическими свойствами.
Гомологический ряд алканов начинается с метана, имеющего один углеродный атом. Первые четыре члена ряда имеют тривиальные (случайные или исторические) названия, названия же остальных представителей являются производными греческих и латинских числительных в соответствии с количеством атомов углерода в наиболее длинной цепи молекулы. Физические свойства гомологов плавно меняются с изменением молярной массы, что особенно заметно по температурам кипения алканов (°С):
СН4 метан (т. пл. = –182.5, т. кип. = –164.0)
СН3-СН3 этан (т. пл. = –183.3, т. кип. = –88.6)
СН3-СН2-СН3 пропан (т. пл. = –189.7, т. кип. = –42.1)
СН3-СН2-СН2-СН3 бутан (т. пл. = –138.4, т.кип = –0.5)
СН3-СН2-СН2-СН2-СН3 пентан (т. пл. = –129.7, т. кип. = 36.1)
СН3(СН2)4СН3 гексан (т. пл. = –95, т. кип. = 69)
СН3(СН2)5СН3 гептан (т. кип. = –90.5, т. кип. = 98.4)
СН3(СН2)6СН3 октан (т. кип. = –56.8, т. кип. = 125.7)
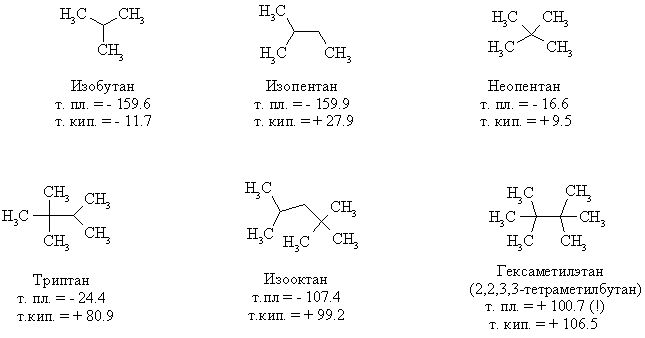
Начиная с бутана, алканы существуют в нескольких изомерных структурах, т.к. наличие в молекуле более чем трех атомов углерода открывает возможность для существования разветвленных цепей. Это явление называется структурной изомерией. Бутан имеет 2 изомера, пентан – три, гептан – 9, декан – 75 изомеров. Наиболее распространенные из разветвленных алканов имеют устоявшиеся названия, тогда как для остальных нужно применять номенклатуру IUPAC. Физические свойства разветвленных алканов зачастую отличаются от свойств их линейных изомеров. Особенно это касается температуры плавления, которая сильно зависит от симметрии молекулы:

Все атомы углерода в молекулах алканов имеют sp3-гибридизацию, оси орбиталей направлены к углам тетраэдра, валентный угол равен 109,5°. Длины связей С-С составляют 154 пм, С-Н – 109 пм.
Молекула метана представляет собой правильный тетраэдр, в молекуле этана два тетраэдрических метила связаны между собой вершинами. σ-Связь позволяет структурным фрагментам вращаться вокруг ее оси, поэтому этан может существовать в виде двух конформаций: заторможенной и заслоненной. Заторможенная коформация на 15 кДж/моль выгоднее заслоненной.


Для последующих гомологов метана число возможных конформаций значительно больше.