Стереоизомерия
Энантиомерия
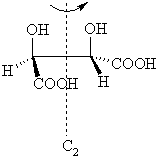
Энантиомерия – явление существования энантиомеров (оптических антиподов), соединений, относящихся друг к другу как предмет и его зеркальное отражение. Энантиомеры существуют не только для истинно асимметричных молекул (т.е. молекул, лишенных любых элементов симметрии), но и в случае хиральных молекул. Что же такое хиральность и чем она отличается от асимметрии?
Элементы симметрии
Молекула симметрична, если при перестановке в ней местами атомов или атомных групп не происходит никаких изменений ее структуры. Перестанавливаемые части молекулы по симметрии эквивалентны, они неразличимы, хотя и не идентичны. Их перестановка возможна с помощью операций симметрии, которые, в свою очередь, могут быть проведены с элементами симметрии. На основе свойств симметрии становится возможной четкая классификация стереоизомеров.
Элементы симметрии представляют собой геометрические места в структуре молекулы, относительно которых осуществляются операции симметрии – вращение, отражение, инверсия и вращение с отражением.
Элементы симметрии делятся на два вида. Элементы симметрии 1 рода – оси симметрии (оси вращения, символ «Сn»).
Элементы симметрии 2 рода – плоскости симметрии (зеркальные плоскости, символ «σ»), центры симметрии (центры инверсии, символ «i»), оси зеркального отражения (символ «Sn»).
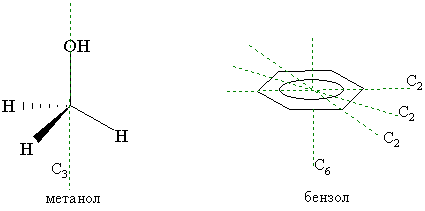
Ось симметрии. Если вращение молекулы вокруг какой-либо проходящей через нее оси на угол 360°/n приводит к структуре, не отличающейся от исходной, то такую ось называют осью симметрии n-го порядка Сn. Понятно, что условию n=1 удовлетворяет любая молекула, так как при этом она вращается на 360°. Так, молекула метанола имеет ось симметрии третьего порядка С3 в направлении связи С – ОН. В бензоле наряду с шестью осями С2, лежащими в плоскости молекулы и проходящими через центр симметрии, имеется еще ось С6, также проходящая через центр симметрии, но перпендикулярная к плоскости кольца. Чем выше порядок оси симметрии (n), тем выше симметричность молекулы.

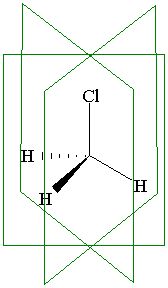
Плоскость симметрии. Плоскость, проходящая через молекулу и делящая ее на две зеркально-равные части, называется плоскостью симметрии σ. Так хлорметан имеет три плоскости симметрии.
Все плоские молекулы имеют, по крайней мере, одну плоскость симметрии – плоскость молекулы. Линейные же молекулы содержат бесконечное множество плоскостей симметрии.
Центр симметрии – это точка в молекуле, относительно которой на прямой, проходящей через нее, тождественные заместители находятся на одинаковом расстоянии (i). В молекуле не может быть более одного центра симметрии. Так, центры симметрии имеют молекулы этилена и бензола.
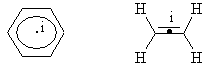
Ось зеркального отражения. Если комбинация вращения вокруг какой-либо проходящей через молекулу оси на угол 360°/n и последующего зеркального отражения каждого из атомов в плоскости, перпендикулярной к этой оси, приводит к эквивалентной ориентации, то такая ось носит название оси зеркального отражения n-го порядка. Так, в транс-1,2-дихлорэтене имеется ось зеркального вращения второго порядка S2, а заторможенная конформация этана содержит ось зеркального отражения шестого порядка S6:
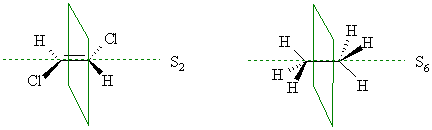
Молекулы, которые содержат элементы симметрии II рода, обладают симметрией отражения и называются ахиральными или недиссимметричными.
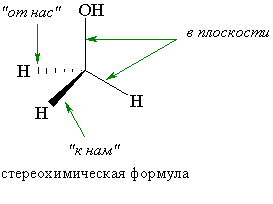
Атом углерода в sp3-гибридизированном состоянии имеет тетраэдрическую конфигурацию, т. е. располагается в центре воображаемого тетраэдра, а четыре его заместителя находятся в вершинах тетраэдра. Тетраэдрическая конфигурация на плоскости изображается с помощью стереохимических формул.
Любой предмет, имеющий плоскость, центр или зеркально-поворотную ось симметрии можно совместить с его зеркальным отображением. Т.е. такие молекулы будут ахиральны, т.е. лишенные хиральности. Если молекулы не имеют элементов симметрии или имеют только поворотные оси симметрии, то их нельзя совместить с их зеркальным отображением, следовательно, они являются хиральными. При этом асимметричные молекулы – те, что лишены любых элементов симметрии.
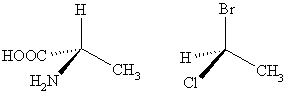
Если при sp3-гибридизованном атоме углерода все четыре заместителя разные, как в молекуле бутанола-2, то такая молекула уже не имеет элементов симметрии II рода. Это обстоятельство рождает новое явление – хиральность:

Хиральность (рукоподобие, от греч. cheir – рука) заключается в парности существования молекул, являющихся друг по отношению к другу предметом и несовместимым с ним его зеркальным отображением. Это явление характерно и для некоторых материальных объектов, например, левая и правая рука, право- и левозакрученная спирали (винты, болты с левой и правой нарезкой), модификации кристаллов и т. д. Общим критерием, присущим всем хиральным объектам, является отсутствие элементов симметрии II рода.
Различают следующие типы хиральности – центр (точечная хиральность), ось (аксиальная хиральность), плоскость (планарная хиральность) и спиральность (топологическая хиральность). Частным случаем хирального центра является асимметричный атом углерода – sp3-гибридизованный атом углерода, у которого все четыре заместителя различные. Очевидно, что у гетерофункциональных соединений резко возрастает возможность образования такого хирального центра и существования таких молекул в виде правых и левых (зеркальных) пространственных изомеров.
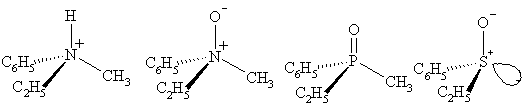
Существуют и неуглеродные хиральные центры. Такая точечная хиральность встречается, например, в четвертичных аммониевых солях и N-оксидах (хиральный атом азота), фосфиноксидах (хиральный атом фосфора), сульфоксидах (хиральный атом серы).
Следует подчеркнуть, что все асимметрические молекулы хиральны, но, с другой стороны, не все хиральные молекулы асимметричны.
Состояние молекулярной асимметрии не ограничивается только молекулами, содержащими асимметрические центры; асимметричными в целом способны быть и атомные ансамбли, не содержащие асимметрического центра. В качестве примера таких соединений можно привести замещенные аллены и бифенилы, проявляющие аксиальную хиральность; замещенные ферроцены, имеющие планарную хиральность; гексагелицен, катенаты и ротаксаны – как представители соединений, обладающих спиральностью. Спиральность – представляет собой особый вид хиральности, наиболее характерный для биополимеров (полисахаридов, белков, нуклеиновых кислот). Спираль всегда хиральна, так как помимо винтовой оси и шага она характеризуется также и типом винтообразного движения (по или против часовой стрелки – право- и левозакрученные спирали). Это более высокий уровень хиральности.
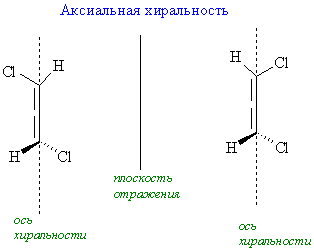
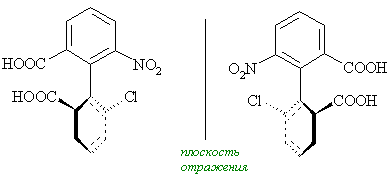
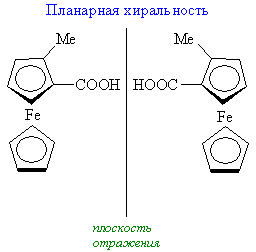
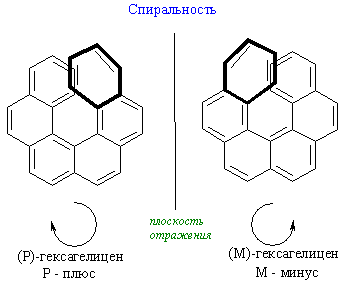
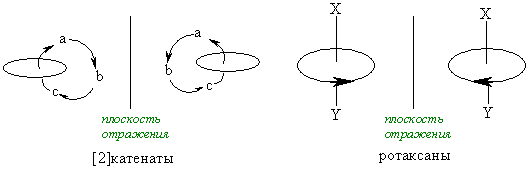
Хиральные объекты могут обладать поворотными осями симметрии. К их числу относятся молекулы, имеющие одну ось симметрии (С2 или С3), которые могут быть совмещены сами с собой после поворота на 180°, однако остаются не совмещаемыми после отражения в зеркальной плоскости (поэтому они и хиральны):