
Циклоалканы
Строение циклоалканов
Свойства циклоалканов в зависимости от размера цикла имеют свои особенности, и поэтому целесообразно рассматривать их для каждого цикла отдельно. Строение циклических соединений изучалось еще в прошлом веке, и были попытки найти закономерности, объясняющие своеобразие реакционной способности каждого цикла. Адольфом фон Байером была предложена теория напряжений валентных углов, согласно которой молекула тем стабильнее, чем ближе значения валентных углов к нормальному. Эта теория объясняла, почему циклопропан мало устойчив, но она не смогла объяснить высокую устойчивость циклогексана, потому что исходила из представлений о плоской геометрии циклов. Действительно, в циклопропане валентный угол соответствует углу в равностороннем треугольнике (60°), тогда как нормальный валентный угол sp3-С-атома равен 109,5°. Это означает, что циклопропановое кольцо испытывает большое напряжение и стремится раскрыться, поэтому циклопропан ведет себя в некоторых реакциях как алкен.
Структурные измерения и квантово-химические расчеты молекулы циклопропана дают следующие геометрические параметры:

Объяснение строения циклопропана в свете этих данных заставляет предположить, что связи в кольце образованы гибридными орбиталями с вкладом s-характера лишь 17% против 25% при гибридизации sp3 (об этом можно судить, например, по величине энергии ионизации: циклопропан 10,5 эВ, пропан 11,7 эВ, пропен 9,7 эВ). Внешние орбитали имеют 33% s-вклада (т.е. ближе к sp2-гибридизации).
Сравнение величин теплот сгорания ряда циклоалканов в расчете на одну метиленовую группу показывает, что циклопропан является самым богатым энергией циклоалканом (38,5 кДж/моль). За точку отсчета принят циклогексан (0 кДж/моль).
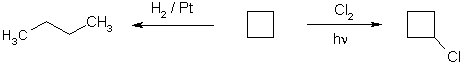
Циклопропан проявляет химические свойства как алканов, так и непредельных соединений. Гидрирование, взаимодействие с бромо- и хлороводором в воде, бромом при нагревании и на свету приводит к раскрытию цикла.

Напротив, при действии хлора на свету он, аналогично алканам, подвергается замещению – хлорированию.

Циклобутан, как и другие циклоалканы с циклом больше трехчленного, имеет неплоское кольцо. Оно представляет собой геометрическую фигуру с перегибом по линии соединяющей противоположные углеродные атомы, что обусловлено внутримолекулярным отталкиванием атомов водорода. Поэтому монозамещенные циклобутаны существуют в двух конформациях, которые, однако, легко переходят друг в друга и не могут быть разделены.

Кольцо циклобутана более устойчиво к действию многих реагентов, чем кольцо циклопропана. Для него более характерными являются реакции замещения, однако каталитическое гидрирование приводит к раскрытию кольца.
Молекула циклопентана образует правильный пятиугольник с внутренним углом 105°, близким по величине к валентному углу тетраэдрического атома углерода. Однако, вследствие внутримолекулярного отталкивания атомов водорода, происходит искажение плоскости молекулы.

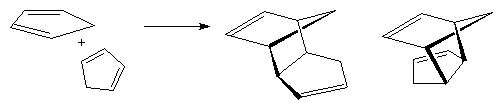
Циклопентан проявляет свойства, характерные для алканов и реакции раскрытия цикла для него нехарактерны. Повышенный интерес вызывает циклопентадиен. Он является активным субстратом в реакциях диенового синтеза, при хранении обратимо димеризуется с образованием эндо- и экзо-аддуктов Дильса-Альдера. При перегонке оба димера превращаются в исходный циклопентадиен с примесью полимерных продуктов.
Если бы молекула циклогексана была плоской, как предполагал А. ф. Байер, то в ней наблюдалось бы значительное напряжение валентных углов (120° против 109,5°). Сейчас известно, что циклогексан неплоский, четыре атома углерода находятся в одной плоскости, а два выходят из нее. Возможны три пространственные конформации циклогексана: кресло – С-атомы расположены по разные стороны плоскости, ванна – по одну. Из-за внутримолекулярного отталкивания атомов водорода более выгодна форма кресла (на 29,3 кДж/моль). Промежуточное положение занимает конформация, которую называют твист-формой – это искаженная ванна, она на 6,3 кДж/моль выгоднее ванны.

Кресло Ванна Твист
Когда молекула циклогексана находится в конформации кресла, атомы водорода в ней можно различить на экваториальные (ориентированные ближе к плоскости кольца) и аксиальные.

Однако, в химическом отношении все атомы водорода равноценны, т.к. конформации быстро переходят друг в друга. Реакционная способность циклогексана аналогично алканам и для него характерны реакции свободнорадикального замещения: хлорирование, нитрование по М. Коновалову. Однако в отличие от циклопропана и циклобутана каталитическое гидрирование требует жестких условий

Из всех циклоалканов циклогексан имеет самое устойчивое кольцо: величина теплоты сгорания в расчете на одну метиленовую группу, равная 659 кДж/моль, принята за нулевую при сравнении с другими циклоалканами.
При пропускании циклогексана или его алкилзамещенных через никелевый или платиновый катализатор при 200 °С происходит дегидрирование кольца и его превращение в ароматическую систему. Эта реакция, однако, препаративного значения не имеет, т.к. производные бензола зачастую доступнее производных циклогексана с теми же заместителями.
