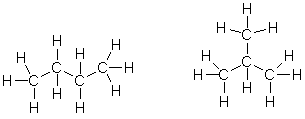
Предмет органической химии
Теория строения А. М. Бутлерова
Ни теория радикалов, ни теория типов не могли дать ответа на вопрос: являются ли молекулы беспорядочным нагромождением атомов, удерживаемых силами притяжения, или они представляют собой частицы с определенным строением, которое можно установить, исследуя свойства вещества. В органической химии к этому времени уже накопились факты и обобщения, которые могли служить основой для решения вопроса о строении молекул.
Решающую роль сыграло открытие валентности элементов. Э. Франкланд (1853) нашел, что каждый металл дает соединения со строго определенным числом органических радикалов; это число и представляет собой валентность данного металла. Так, были получены следующие соединения:
CH3Na |
(CH3)2Hg |
(CH3)3Al |
(CH3)4Sn |
метилнатрий |
диметилртуть |
триметилалюминий |
тетраметилолово |
Стало ясно, что атомы могут соединяться в молекулы только в отношениях, разрешенных валентностью атомов. Было установлено, что углерод четырехвалентен (Ф. А. Кекуле, 1858).
Понятие валентности подводило к мысли о том, что молекулы имеют определенное строение, но открытым оставался вопрос, как определять строение молекулы. Ответ на него дала теория А. М. Бутлерова.
Основная идея была сформулирована им в 1861 г. в статье «О химическом строении вещества». Он писал: «Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу».
Сформулировав понятие химического строения, Бутлеров дает новое определение природы вещества: «Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением».
Следовательно, строение сложного вещества может быть установлено на основании его превращений, а химические свойства (реакционная способность) могут быть предсказаны на основании строения. Бутлеров считал, что для каждого соединения возможна лишь одна структурная формула.
Замечательным успехом теории строения явилось объяснение явления изомерии. Так, четвертый углеродный атом может быть присоединен к трехуглеродной цепи двояким способом: а) к крайнему атому и б) к среднему. Следовательно, возможен не один, а два различных порядка связи атомов в молекулах общей формулы С4Н10:
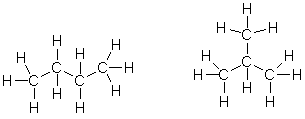
Молекулярной формулой С4Н10 могут обладать два вещества, имеющие одинаковый качественный и количественный состав, а также одинаковую молекулярную массу, но отличающиеся расположением атомов в молекулах (строением). Такие два вещества называются изомерами.
Позднее В. В. Марковников (1869) в своей диссертации «Материалы по вопросу о взаимном влиянии атомов в химических соединениях» высказал ряд положений, чрезвычайно важных для дальнейшего развития органической химии как в теоретическом, так и в практическом отношении. Одним из них явилось «правило Марковникова» о порядке присоединения галогеноводородов и хлорноватистой кислоты к несимметричным алкенам, другим – положение о большей легкости замещения атома водорода при третичном углеродном атоме по сравнению с атомами водорода у вторичного и первичного углеродных атомов и замещения атома водорода при вторичном углеродном атоме по сравнению с водородным атомом у первичного углеродного атома.
Основные положения и следствия теории строения Бутлерова могут быть кратко сформулированы следующим образом.
1. В молекулах соединений существует определенный порядок связи атомов, который и носит название строения.
2. Химические свойства соединения определяются составом и строением его молекул.
3. Различное строение при одном и том же составе и молекулярной массе вещества обусловливает явление изомерии.
4. Так как при отдельных реакциях изменяются не все, а только некоторые части молекул, то, изучая продукты химических превращений соединения, можно установить его строение.
5. Химический характер (т. е. реакционная способность) атомов, входящих в молекулу, меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Это изменение химического характера обусловливается главным образом взаимным влиянием непосредственно связанных друг с другом атомов. Взаимное влияние атомов, не связанных непосредственно, обычно проявляется значительно слабее.
Слова Бутлерова о значении предшествовавших учений и теорий определяют дальнейшую судьбу и значение теории химического строения: «Они (прежние теории) все еще остаются пригодными в известном смысле и, отживая, входят в виде более или менее измененном как часть в состав новых теорий, более обширных. Те зависимости между фактами, которые были указаны прежними теориями, подтверждаются, расширяются и объясняются еще лучше новыми теориями, а те открытия, к которым старые теории привели, остаются прочными памятниками их заслуг».