Предмет органической химии
Способы изображения органических молекул, пространственные модели
В настоящее время считается общепринятым, что одна прямая линия, соединяющая два атома, обозначает одну двухэлектронную связь (простая связь), на образование которой затрачивается по одной валентности от каждого из связанных атомов, две линии – одну четырехэлектронную связь (двойная связь), три линии – одну шестиэлектронную связь (тройная связь).
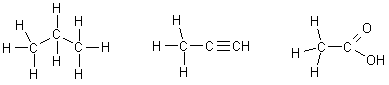
Изображение соединения с известным порядком связей между всеми атомами с помощью связей такого типа называется структурной формулой:

Для экономии времени и места чаще применяют сокращенные формулы, в которых часть связей подразумевается, но не пишется:
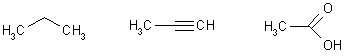
Иногда, особенно в карбоциклических и гетероциклических рядах, формулы еще больше упрощаются: не пишутся не только некоторые связи, но и часть атомов углерода и водорода не изображается, а лишь подразумевается (в местах пересечения линий); упрощенные формулы:
Тетраэдрическая модель атома углерода
Основные представления о химическом строении, заложенные А.М. Бутлеровым, были дополнены Я. Г. Вант-Гоффом и Ж. А. Ле-Белем (1874), которые развили идею о пространственном расположении атомов в молекуле органического вещества и поставили вопрос о пространственной конфигурации и конформации молекул. Работа Вант-Гоффа «Химия в пространстве» (1874) положила начало плодотворному направлению органической химии – стереохимии, т. е. учению о пространственном строении.
Вант-Гофф предложил тетраэдрическую модель атома углерода. Согласно этой теории, четыре валентности атома углерода в метане направлены к четырем углам тетраэдра, в центре которого находится углеродный атом, а в вершинах – атомы водорода (а). Этан, согласно Вант-Гоффу, можно представить себе как два тетраэдра, соединенных вершинами и свободно вращающихся около общей оси (6). Модель молекулы этилена представляет собой два тетраэдра, соединенных ребрами (в), а молекулы с тройной связью изображаются моделью, в которой тетраэдры соприкасаются плоскостями (г).
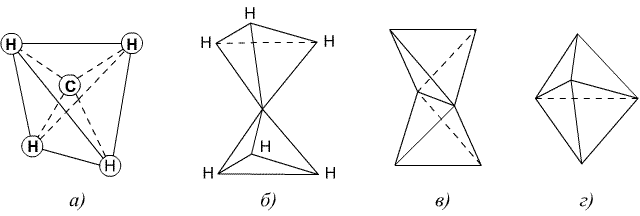
Модели по Вант-Гоффу: метана (а), этана (б), этилена (в) и ацетилена
(г)
Такого типа модели оказались весьма удачными и для сложных молекул. Они с успехом используются и сегодня для объяснения ряда стереохимических вопросов. Теория, предложенная Вант-Гоффом, хотя и пригодная почти во всех случаях, не давала, однако, обоснованного объяснения типа и существа связывающих сил в молекулах.