Предмет органической химии
Первые теоретические воззрения. Теория радикалов
Первая теория в органической химии – теория радикалов – была тесно связана с электрохимической теорией Й. Берцелиуса. Основываясь главным образом на факте электролиза неорганических соединений, Берцелиус считал, что все химические вещества состоят из электроотрицательных и электроположительных атомов или групп атомов, удерживаемых в молекуле силами электростатического притяжения. Теория радикалов представляла собой фактически модификацию электрохимической теории Берцелиуса применительно к органической химии.
Экспериментальным основанием для создания теории радикалов послужили исследования соединений циана, проведенные Гей-Люссаком в 1815 году. Впервые было установлено, что в ряде химических превращений группа из нескольких атомов в неизменном виде переходит из молекулы одного вещества в молекулу другого, подобно тому как переходят из молекулы в молекулу атомы элементов. Такие «неизменяемые» группы атомов получили название радикалов.
Мощной поддержкой теории радикалов оказались осуществленные позднее (1832) Ю. Либихом и Ф. Вёлером исследования «горько-миндального масла» – вещества, которое теперь называется бензойным альдегидом С7Н6О. При изучении реакций этого вещества был получен ряд соединений, неизменно содержащих в своей молекуле группу атомов С7Н5О, названную ими радикалом «бензоилом»:
С7Н5О–Н – водородистый бензоил (бензойный альдегид);
С7Н5О–Сl – хлористый бензоил;
С7Н5О–ОН – гидрат окиси бензоила (бензойная кислота);
С7Н5О–ONa – бензойнонатриевая соль и т. д.
Результаты исследований были восприняты как доказательство того, что органические вещества состоят из радикалов, точно так же, как неорганические вещества – из атомов.
На определенном этапе развития органической химии теория радикалов сыграла значительную роль, впервые дав химикам руководящую нить в исследовании органического вещества. Это оказалось возможным потому, что в основе теории радикалов лежало очень важное обобщение: при химических реакциях группы атомов (т. е. радикалы) в неизменном виде входят в образующиеся при этих реакциях молекулы.
Вместе с тем теория радикалов имела и ряд принципиальных недостатков. Решающим ударом по теории радикалов явилось открытие французским химиком Ж. Дюма химических реакций, при которых легко изменялись некоторые из наиболее обычных радикалов. Он открыл, что атомы хлора могут замещать в молекулах органического вещества атомы водорода – реакция металепсии.
При действии хлора на уксусную кислоту атом водорода в радикале ацетиле легко замещался на атом хлора, причем получающееся вещество по химическим свойствам мало отличалось от уксусной кислоты:
| С2Н3О –OH + Cl2 → С2Н2СlО –ОН + НСl; | C2Cl3O –OH |
| уксусная к-та хлоруксусная | трихлоруксусная к-та |
При действии хлора на полученное вещество легко происходило дальнейшее замещение второго, а затем и третьего атома водорода на атом хлора. Соединения, получившиеся в результате этих реакций, по химическим свойствам также мало отличались как от хлоруксусной, так и от уксусной кислоты.
Таким образом, при подобных реакциях не только изменялся сам радикал, но, кроме того, замена электроположительного водорода на электроотрицательный хлор мало влияла на химические свойства соединения.
Теория типов
Теория радикалов обращала внимание, главным образом, на ту часть молекулы органических веществ, которая при обычных химических превращениях оставалась неизменной. Меньше внимания уделялось легко изменяющейся части молекулы и причинам ее изменений. Сменившая теорию радикалов теория типов, наоборот, обратила внимание именно на наиболее изменчивые части молекулы и на причины этой изменчивости. Теория типов подчеркивала, что в реакциях органических веществ обнаруживается сходство с реакциями простейших неорганических соединений. Органические вещества предлагалось рассматривать образованными от простейших неорганических веществ путем замещения в последних одного или нескольких атомов на разные органические группы, названные «остатками» (чтобы не употреблять отвергнутого слова «радикал»). При этом простейшие неорганические вещества являлись для образованных от них органических веществ типами в том смысле, что молекулы этих органических веществ обладали характерными, «типичными», реакциями исходных неорганических молекул.
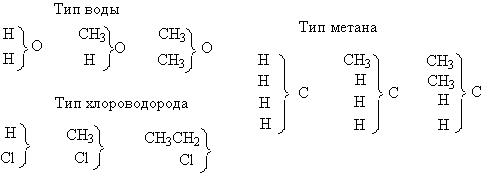
Основоположник теории типов Ш. Жерар предложил разделить органические вещества на группы, близкие по своему типу к воде, хлороводороду, аммиаку. Несколько позднее Ф. А. Кекуле по аналогии с типом воды ввел тип сероводорода.

Приведенные типические формулы показывают, например, что, заменяя в молекуле воды один атом водорода на остаток СН3, можно получить метиловый спирт, заменяя оба атома водорода – диметиловый эфир и т. д. Аналогичные группы составляют вещества типа НСl, NH3 и т. д.
Согласно теории типов, различные радикалы, образующие молекулу, не обладают двумя противоположными зарядами; в связи с этим система Жерара получила название «унитарной системы» в противоположность представлениям Берцелиуса, которые легли в основание теории радикалов.
Сходство органических соединений с неорганическими, лежащими в основе данного типа, заключается не только в составе и способах получения, но и в ряде свойств. Например, металлический натрий реагирует со спиртом так же, как с водой:
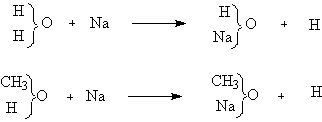
Сходство органических соединений с некоторыми типичными неорганическими позволило в известной степени предсказывать свойства вновь открываемых органических соединений, если удавалось отнести их к определенному типу.
По мере дальнейшего накопления экспериментального материала, рамки теории типов становились тесными для развития органической химии. Сторонники теории типов, пытаясь спасти ее, начали вводить усложнения. Во многих случаях одно и то же соединение изображали десятками типических формул. По мере открытия новых свойств соединения число типических формул для него увеличивалось. Теория типов зашла в тупик; она была способна идти только за экспериментом, а в предсказательном отношении была беспомощна.