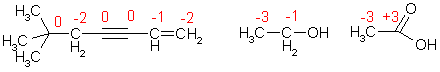
Теоретические представления в органической химии
Углерод, его особенности
Углерод расположен в главной подгруппе 4-й группы Периодической системы. В стационарном состоянии атом углерода имеет электронную конфигурацию 1s22s22p2. Этой конфигурации соответствует оксид СО, однако в органических соединениях и большинстве неорганичеких веществ более характерным состоянием углерода является 1s22s12p3. Четыре неспаренных электрона дают возможность образовывать связи с атомами углерода, а также с атомами как электроотрицательных, так и электроположительных элементов. Четыре валентности атома углерода могут образовывать ковалентные связи двух типов: σ-связи и π-связи. Оба типа связи позволяют углероду быть связанным тройной, двойной и ординарной связью.
Тогда как атомы элементов-органогенов имеют обычно степени окисления [кислород (-2), азот (-3), фосфор (+5)], углерод может проявлять в соединениях любые степени окисления от (+4) до (-4). В ходе реакций он может присоединять или отдавать электроны, выступая в роли окислителя или восстановителя. Направление перехода электронов зависит от свойств другого реагента.
Степень окисления есть условный заряд атома, который рассчитывается с учетом того, что общая электронная пара связи между атомами полностью относится к более электроотрицательному атому (электроотрицательность характеризует способность атома удерживать электроны, особенно внешние). Общие пары электронов между атомами одного элемента при определении степени окисления не учитываются.
Степени окисления атомов углерода в соединениях
| -4 |
CH4 |
| -3 |
CH3-CH3; R-CH3 |
| -2 |
R2CH2; H2C=CH2; CH3Cl; CH3OH; RCH2-CH2R |
| -1 |
R3CH; HC≡CH; RHC=CHR; R2CH-CHR2; C6H6; RCH2OH |
| 0 |
R4C; R3C-CR3; R2C=CR2; RC≡CR; H2C=O; CH2Cl2; R2CHOH |
| +1 |
R3COH; RHC=O |
| +2 |
R2C=O; HCOOH; CHCl3 |
| +3 |
RCOOH |
| +4 |
CO2; CCl4; H2CO3 |
В молекуле органического соединения степени окисления атомов углерода могут быть различными:
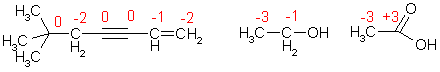
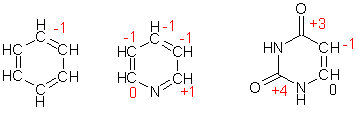
Таким образом, степень окисления любого атома углерода в органических соединениях равна алгебраической сумме числа всех его связей с атомами более электроотрицательных элементов (кислород, азот, сера,…), учитываемых со знаком (+), и числа связей с атомами водорода, учитываемых со знаком (-), а все его связи с соседними атомами углерода не учитываются.
Степень окисления является условной величиной, но ее изменение указывает на окислительно-восстановительный характер реакции. Атомы углерода обладают окислительно-восстановительной двойственностью, в органической химии распространены реакции окислительно-восстановительной дисмутации за счет атомов углерода, которые могут протекать как межмолекулярно, так и в рамках одной молекулы.
RCH=CHR + H2 → RCH2-CH2R
CH3CH2Br + 2Na + BrCH2CH3 → CH3CH2CH2CH3 + 2NaBr
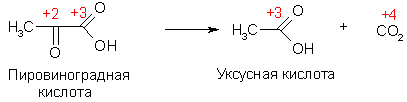
Гибридные состояния атома углерода.
Электронная конфигурация атома углерода в основном состоянии 1s22s22p2 , в возбужденном– 1s22s12p3 . Различные атомные орбитали, имеющие близкие значения уровней энергии, взаимодействуют между собой, образуя гибридные (смешанные) орбитали с одинаковой формой и энергией. В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном из трех состояний гибридизации.
1. sp3-Гибридизация (тетраэдрическая), при которой взаимодействуют 1 s и 3 p орбитали. Возникают 4 одинаковых электоронных орбитали, направленные к вершинам тетраэдра, в центре которого находится ядро атома углерода. Угол между нами 109°28’, они имеют форму объемной восьмерки, одна из лопастей которой значительно больше другой.
2. sp2-Гибридизация (тригональная), при которой взаимодействуют 1 s и 2 p орбитали. Возникают 3 одинаковых электронных орбитали, с осями расположенными в одной плоскости и направленными из центра треугольника к его вершинам под углом 120°. sp2-Гибридные орбитали имеют форму объемной восьмерки, одна из лопастей которой значительно больше другой. Оставшаяся негибридизованная р-орбиталь перпендикулярна плоскости, в которой лежат гибридные орбитали.
3. sp-Гибридизация (дигональная), при которой взаимодействуют 1 s и 1 p орбитали. Возникают 2 одинаковых электронных орбитали, расположенные линейно под углом 180°, они имеют форму объемной восьмерки, одна из лопастей которой значительно больше другой. Оставшаяся негибридизованные орбитали взаимно перпендикулярны и перпендикулярны плоскости, в которой лежат sp-гибридные орбитали.
Упражнения к теме "Теоретические представления в органической химии"