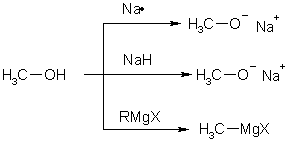
Спирты
Свойства спиртов
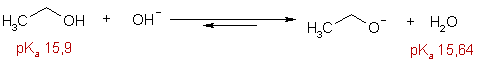
Кислотность
Величины рКа алканолов, измеренные в водных растворах растут от метанола с увеличением длины углеродной цепи и со степенью замещенности α-углеродного атома.
| Спирт |
CH3OH |
C2H5OH |
(CH3)2CHOH |
(CH3)3COH |
(CF3)3COH |
H2O |
| рКа |
15,5 |
15,9 |
17,1 |
18,0 |
5,4 |
15,64 |
Протон может быть удален из гидроксильной группы действием достаточно сильного основания. Спирты взаимодействуют, например, с металлическим натрием, гидридом натрия, реактивами Гриньяра, образуя соответствующие солеобразные соединения, называемые в общем случае алкоголятами или алкоксидами
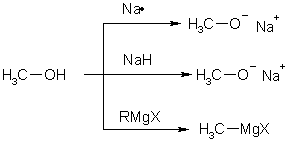
Как видно из приведенной выше таблицы, константы кислотности низших алканолов и воды близки, поэтому при взаимодействии их со щелочами устанавливается динамическое равновесие, которое, однако, смещено влево
Алкоголяты
Алкоголят-ионы являются намного более сильными нуклеофилами чем соответствующие спирты, поэтому они способны к взаимодействию с такими слабыми электрофилами, с которыми сами спирты не реагируют. Благодаря этому свойству они применяются для получения простых эфиров: при их взаимодействии с алкилгалогенидами образуются простые и составные диалкиловые эфиры (синтез Александра Уильямсона).
![]()
Алкоголяты способны к взаимодействию и с другими электрофилами, например, галогенопризводными ароматическими соединениями.
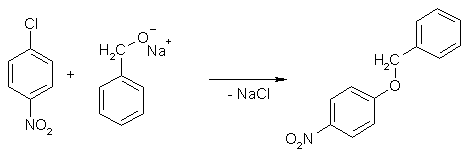
По отношению к спирту это превращение рассматривают как реакцию алкилирования (арилирирования), по отношению к галогенопроизводному как реакцию нуклеофильного замещения.
Общим свойством спиртов является основность, которая обусловлена неподеленными электронными парами атома кислорода. С кислотами Льюиса спирты образуют оксониевые катионы (в случае протона – гидроксониевые).
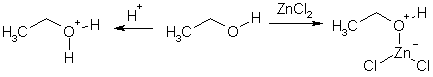
Водородные связи
Наличие у спиртового гидроксила одновременно кислотных и основных свойств придает спиртам способность образовывать ассоциаты за счет межмолекулярных водородных связей. Это является причиной более высоких температур кипения спиртов в сравнении с алканами с такой же или даже большей молярной массой. Например, метанол (М = 32) кипит при 64 °С, бутан (М = 58) – при 4 °С. Энергия водородной связи невелика (около 20 кДж/моль), но большое количество водородных связей требует значительного расхода энергии на их разрыв при нагревании спирта до температуры кипения. Низшие спирты благодаря водородным связям неограниченно смешиваются с водой.
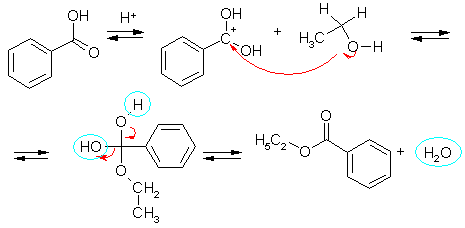
Электронные пары атома кислорода обусловливают также нуклеофильность спиртов. Это проявляется во взаимодействии с сильными электрофилами. Например, в галогенангидридах и ангидридах кислот действием спиртов замещается и уходит в форме аниона группа при ацильном атоме углерода. Эту реакцию обычно называют ацилированием спиртов, потому что в молекулу спирта вместо водорода вводится ацильная группа .

Реакция ацилирования спиртов карбоновыми кислотами эффективно катализируется сильными минеральными кислотами, Протоны, координируясь с электронными парами карбонильного кислорода карбоксильной группы, повышают электрофильность ацильного углерода. Благодаря тому, что в результате этого происходит превращение кислоты в эфир реакция получила название этерификации (Ether – эфир – физический вакуум, обладающий некоторыми свойствами материи).
Образование сложных эфиров при действии ангидридов, галогенангидридов, сложных эфиров происходит легче, когда реакцию проводят в присутствии основания, роль которого состоит в переводе гидроксипроизводного в форму более нуклеофильного алкоголята. Это явление известно как основной катализ ацилирования.
В молекулах спиртов можно осуществить замещение гидроксильной группы. Считают, что реакция, по причине полярности связи С-О, идет как нуклеофильное замещение, механизм которого определяется, главным образом, строением спирта. Как и замещение галогена, первичные спирты предпочтительно реагируют по бимолекулярному механизму, третичные – по диссоциативному. Однако в случае спиртов (по сравнению с например, галогеналканами) необходимо увеличить поляризацию С-О-связи, т.к. положительный заряд на α-углеродном атоме спиртов значительно ниже, чем галогенопроизводных. Этого достигают, как правило, проводя реакцию в присутствии кислот (протонных или Льюиса), а также превращая спирты в более активные эфиры неорганических кислот.
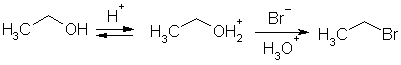
Существует также другая причина необходимости проведения реакции замещения гидроксила галогенид-ионами в кислотной среде, которая, как считают, заключается «качестве» уходящей группы. Хорошей уходящей группой считается такая, которая ходе замещения превращается в термодинамически устойчивую частицу. Так, спирт не реагирует с бромидом калия в нейтральной среде, потому что уходящая группа гидроксид-ион богат энергией и, следовательно, малоустойчив. Напротив, реакция идет в присутствии серной кислоты, так как в результате протонирования гидроксил превращается в гидроксоний и уходит в форме молекулы воды, которая термодинамически намного устойчивее гидроксид-иона.
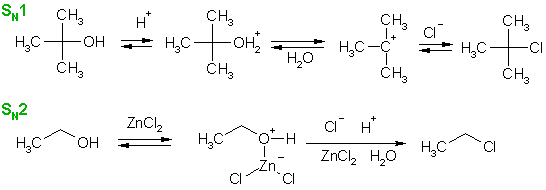
Соляная кислота редко используется для превращения спиртов в хлоропроизводные. Она легко реагирует лишь с третичными спиртами, что объясняется, вероятно, низкой нуклеофильностью хлорид-иона, который способен успешно атаковать лишь "чистый" карбкатион (механизм SN1), но не гидроксониевую частицу, образующуюся в кислой среде из первичного спирта (механизм SN2). Вместе с тем, соляная кислота слабее бромоводородной и поэтому концентрация протонированных молекул спирта и карбкатионов в реакционной среде ниже. Успешному протеканию реакции с соляной кислотой способствует присутствие хлорида цинка (кислота Льюиса), который координируется с электронами кислорода и индуцирует положительный заряд.
Превращение спиртов в эфиры неорганических кислот также повышает их электрофильные свойства. Так, образование диэтилового эфира при нагревании этанола с 96%-ной серной кислотой (130 °С) объясняется тем, что в ходе реакции промежуточно возникает этилсерный эфир, который взаимодействует с другой молекулой спирта. По этому способу получения диэтиловый эфир получил название «серный».

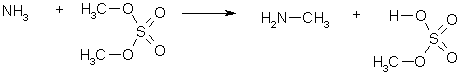
Диалкиловые эфиры серной кислоты, называемые диалкилсульфатами, производятся химическими фирмами и широко применяются для алкилирования спиртов, фенолов в присутствии оснований а также аммиака и аминов.
Иодоводородная кислота обладает достаточной кислотностью и иодид-ион является сильным нуклеофилом, но его сильные восстановительные свойства не всегда позволяют с высокими выходами превращать спирты в алкилиодиды.
Поэтому замещение гидроксила проводят действием трииодида фосфора, который генерируют из красного фосфора и иода непосредственно в реакционном растворе.
![]()
Считают, что на первой стадии реакции трииодид фосфора образует со спиртом эфир (сродство фосфора к кислороду очень велико), который в качестве электрофила участвует в реакции нуклеофильного замещения.
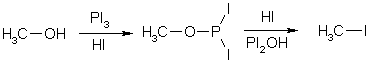
Для превращения спиртов в галогеналканы используют также пентахлорид фосфора и тионилхлорид. В недавнем прошлом были получены экспериментальные доказательство того, что реакция с тионилхлоридом протекает через промежуточное образование ионных пар.
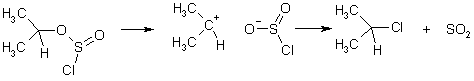
Механизм можно представить следующим образом

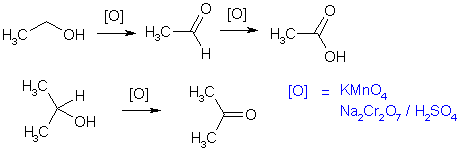
Спирты в обычных условиях устойчивы к действию окислителей. Кислородом воздуха на холоду они не окисляются. Тем не менее, сильные окислители превращают их в альдегиды, кетоны и карбоновые кислоты. Первичные спирты окисляются перманганатом калия или бихроматом натрия в сернокислом растворе. Легче всего происходит окисление до карбоновых кислот. Поэтому для получения альдегида, который кипит при более низкой температуре, чем соответствующий спирт, его отгоняют по мере образования для предохранения от дальнейшего окисления в карбоновую кислоту. Другими методами получения альдегидов из спиртов являются использование мягких окислителей (MnO2, SeO2) и превращение альдегида in situ в более устойчивое производное, например, диацетат.
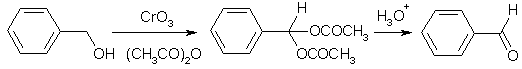
В результате окисления вторичных спиртов с хорошим выходом образуются кетоны, третичные же спирты окисляются трудно, при этом происходит разрыв углеродной цепи и образуются смеси продуктов.
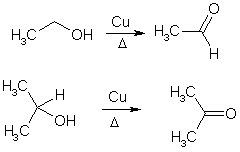
Спирты превращаются в альдегиды и кетоны также в результате дегидрирования при нагревании с катализаторами Cu, Pt, Pd.
Спирты на холоду или при умеренном нагревании с концентрированными минеральными кислотами образуют сложные эфиры. В большей степени это относится к первичным спиртам; вторичные и особенно третичные при нагревании с кислотами претерпевают дегидратацию, превращаясь в непредельные соединения. Сложные эфиры первичных спиртов с серной или фосфорной кислотой так же образуют алкены при высокой температуре. Так, реакция этанола с серной кислотой при 160 °С приводит к этилену, при 120-130 °С – к диэтиловому эфиру, а при 70-80 °С – к моно- или диэтилсульфату в зависимости от соотношения реагентов. Превращение спирта в этилен протекает по механизму бимолекулярного (синхронного) элиминирования (Е2-механизм).
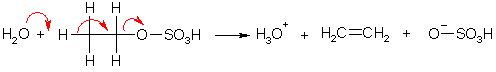
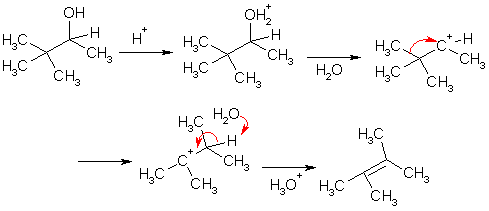
Третичные спирты не образуют эфиров, но легко теряют молекулу воды, что происходит, вероятно, по мономолекулярному механизму отщепления (Е1) через промежуточное образование карбкатиона. Например, третичный бутиловый спирт дегидратируется при нагревании с 15%-ной серной кислотой.
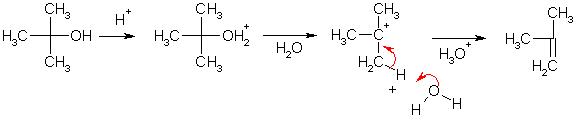
Дегидратация вторичных и третичных спиртов может происходить при нагревании с другими кислотами (кислотами Льюиса), а также на поверхности оксида алюминия при высокой температуре. Ориентация отщепления подчиняется правилу Зайцева (образуются наиболее устойчивые, т.е. более замещенные алкены).
Как видно из приведенных примеров, реакции элиминирования всегда конкурируют с реакциями замещения.
Как и в случае реакций галогеналканов, промежуточное образование карбкатионов не может не привести в ряде случаев к их перегруппировке. Ранее мы встречались с перегруппировкой карбкатионов в более стабильные путем миграции атома водорода к соседнему "ониевому" атому углерода. Однако, мигрировать может не только водород, но так же алкильная или арильная группа. Образующиеся в результате такого превращения алкены отличаются по строению от ожидаемых. Например, довольно известна ретропинаколиновая перегруппировка.