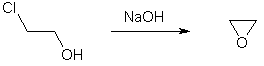
Спирты
Многоатомные спирты
Первый представитель ряда многоатомных спиртов имеет два атома углерода в молекуле, потому что α-дигидроксипроизводные в большинстве случаев неустойчивы и, отщепляя воду, превращаются в оксосоединения (правило Эльтекова-Эрленмейера).
Первый член ряда многоатомных спиртов – этандиол-1,2 обычно называют по тривиальной номенклатуре – этиленгликоль, поэтому все 1,2-двухатомные спирты объединяют под названием гликоли. Трехатомные спирты называются глицеринами по названию самого простого из них – пропантриола-1,2,3.
По своим свойствам этиленгликоль, глицерин и другие полиатомные спирты большей частью похожи на алканолы. Однако у них имеются и некоторые специфические свойства, на которые целесообразно обратить внимание.
Образование ассоциатов за счет водородных связей проявляется у них в большей степени, чем у алканолов, что связано с бóльшим количеством полярных групп по отношению к длине углеродного скелета. Это является причиной более высоких температур кипения, например, температура кипения этиленгликоля 197 °С, а этанола – 78 °С. Этиленгликоль и глицерин представляют собой вязкие жидкости, они неограниченно смешиваются с водой, что также обусловлено высокой степенью ассоциированности.
Этиленгликоль является более сильной кислотой (рКа 14,2), чем этанол (рКа 15,9), потому что каждая из гидроксильных групп испытывает -I-эффект соседнего гидроксила. При действии на гликоли сильных оснований образуется два ряда алкоголятов: по одному и по обоим гидроксилам в зависимости от количества основания.
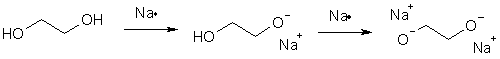
Присутствие двух гидроксильных групп у соседних атомов углерода в молекулах многоатомных спиртов создает благоприятные условия для образования с катионами металлов устойчивых координационных соединений, называемых хелатными комплексами. Образование комплекса меди (II) с глицерином и его строение можно описать схемой
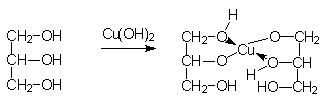

Алкандиоляты щелочных металлов являются сильными нуклеофилами и могут быть легко проалкилированы (реакция Уильямсона). Образующиеся при этом простые эфиры находят применение в органическом синтезе в основном в качестве апротонных растворителей.
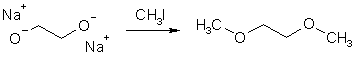
При действии ацилирующих реагентов гликоли образуют два ряда сложных эфиров, глицерины – три. Как и алканолы, многоатомные спирты образуют эфиры не только с карбоновыми, но и с неорганическими кислотами. Например, глицерин встречается в природе в виде сложных эфиров высших алифатических карбоновых кислот, называемых жирами. Растительные жиры состоят преимущественно из глицеридов непредельных олеиновой и пальмитиновой кислот, в животных жирах преобладает ацил насыщенной стеариновой кислоты. Среди эфиров глицерина с минеральными кислотами известен его тринитрат (тринитроглицерин), применяемый как бризантное взрывчатое вещество, его используют также в медицине в качестве сосудорасширяющего препарата.

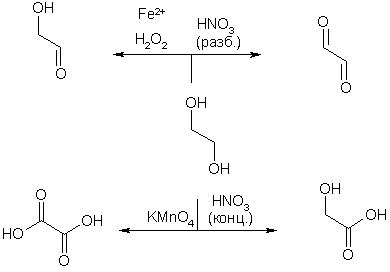
Окисление этиленгликоля, в зависимости от природы окислителя, дает различные продукты.
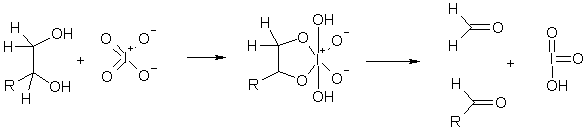
Действие иодной кислоты на 1,2-диолы приводит к расщеплению углеродной цепи и образованию карбонильных соединений (реакция Леона Малапраде). Идентификация образующихся при этом альдегидов используется для установления структуры в химии углеводов.
Этиленгликоль относительно легко дегидратируется. Нагревание этиленгликоля с серной кислотой дает в результате межмолекулярной дегидратации 1,4-диоксан, тогда как в присутствии хлорида цинка реакция протекает по внутримолекулярному механизму, при этом образуется ацетальдегид.
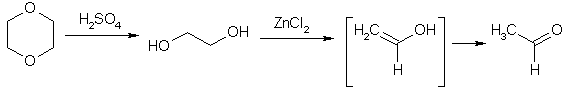
Образование ацетальдегида объясняют тем, что комплекс хлорида цинка с одним из гидроксилов распадется, давая карбокатион, который в результате отщепления протона превращается в виниловый спирт. Последний в кислой среде быстро перегруппировывается в более устойчивую таутомерную форму – ацетальдегид (см. тему «Карбонильные соединения»). В отсутствие кислот виниловый спирт все-таки удается получить, однако период его "полуизомериции" составляет не больше 30 мин.

Дегидратация глицерина действием гидросульфата калия при нагревании приводит к образованию непредельного альдегида – акролеина. Это превращение имеет механизм, аналогичный описанному выше.

Дегидратация дитретичных и дивторичных гликолей, катализируемая серной кислотой, кислотами Льюиса (BF3 и др.) включает в себя стадию миграции алкильной, арильной группы или гидрид-иона. В результате этой перегруппировки образуются карбонильные соединения (пинаколиновая перегруппировка).

Гидроксильные группы многоатомных спиртов, как и в алканолах, могут быть замещены на галоген. Так, этиленгликоль при действии соляной кислоты превращается в этиленхлоргидрин, который переходит в 1,2-дихлорэтан при обработке пентахлоридом фосфора.
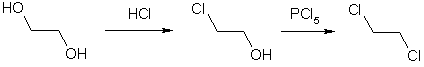
Этиленхлоргидрин под действием щелочи теряет молекулу хлороводорода и превращается в циклическую окись этилена.