
Спирты
Номенклатура спиртов
Гидроксипроизводные предельного алифатического ряда называют спиртами. По систематической номенклатуре названия спиртов образуются путем прибавления суффикса «-ол» к названию соответствующего углеводорода (общее название предельных спиртов – алканолы). Кроме официальной номенклатуры используют другие: русскую (по названию углеводородного радикала, например, «этиловый спирт»), тривиальную (например, древесный спирт), карбинольную (карбинол – метанол, а другие спирты – как его производные, т.е. трет-бутанол может быть назван триметилкарбинолом).

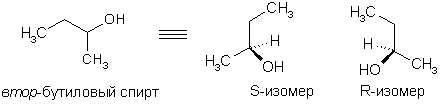
Формуле С4Н9ОН четвертого члена гомологического ряда спиртов отвечают четыре изомера

В гомологическом ряду алканолов наряду с изомерией углеродной цепи и положения гидроксила имеет место оптическая изомерия.
Непредельные спирты бывают двух типов: виниловые спирты, содержаoщие гидроксил при этиленовом углероде, и аллильные спирты, в которых гидроксил отделен от этиленовой связи группой СН2. Ароматические спирты рассматривают как алканолы, в молекулах которых присутствуют ароматические кольца. Те спирты, в которых кратные связи отделены от ОН-группы более чем одним sp3-гибридным атомом углерода, по свойствам не отличаются от обычных алканолов.
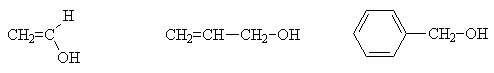
Виниловый Аллиловый Бензиловый
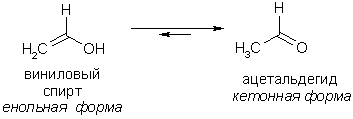
Нужно отметить, что виниловые спирты, не содержащие сильных акцепторов в молекуле, крайне неустойчивы и переходят в более стабильную кето-форму. Они, по сути, являются таутомерной формой карбонильных соединений, которая, как правило, присутствует в веществе в незначительной концентрации:
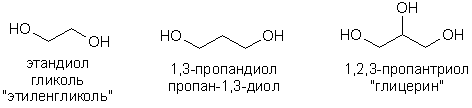
Спиртовая молекула может содержать несколько гидроксильных групп. В соответствии с их количеством различают двух- трех-, многоатомные спирты. Официальные названия многоатомных спиртов образуются путем прибавления окончания -диол, -триол к названию соответствующего углеводорода. Часто применяются тривиальные названия: 1,2-диолы называют гликолями, 1,2,3-триолы – глицеринами.
Длины связей и валентные углы в молекуле метанола приведены на рисунке
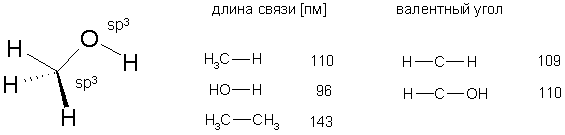
Неподеленные электронные пары атома кислорода расположены на sp3-гибридных орбиталях. ОН-связь имеет такую же длину как в молекуле воды, связь С-Н чуть короче, чем в метане (111,2 пм).
Наличие гидроксильной группы придает спиртам свойства как кислот, так и оснований. Кислотность спиртов обусловлена полярностью связи О-Н, о чем позволяют судить величины дипольных моментов, имеющие значения: μС-О = 0,9 D, μ О-Н = 1,5 D. Эти величины указывают на значительное разделение зарядов в гидроксильной группе, благодаря чему водород весьма легко протонизуется. pKa низших алифатических спиртов близка к pKa воды. В то же время, полярность связи С-О обусловливает возможность замещения гидроксила, о чем будет сказано позднее. Суммарный дипольный момент метанола равен 1,69 D и не соответствует сумме диполей С-О и гидроксила. Это можно объяснить вкладом неподеленных пар электронов кислорода и направлен к кислороду
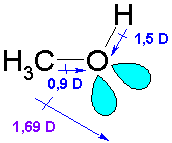
Несвязывающие электронные пары атома кислорода придают спирту свойства оснований и нуклеофилов, способными реагировать с протоном, кислотами Льюиса, С-электрофилами.