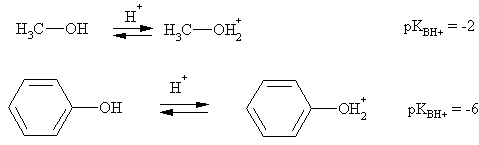Фенолы
Строение фенолов
О полярности фенолов позволяют судить величины дипольных моментов.

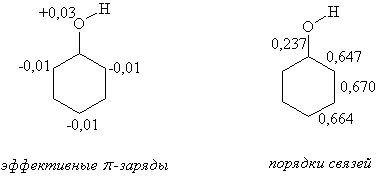
Согласно квантово-химическим расчетам ВЗМО фенола имеет более высокую энергию (α+0,880β), чем у бензола (α+β), что подтверждается величиной энергии ионизации Еи 8,6 эВ, что ниже, чем у бензола (9,24 эВ). Порядок связи С-О в феноле составляет величину 0,237, электронная плотность в орто- и пара- положениях кольца повышена, а на атоме кислорода - понижена. На мета-С-атомах эффективный заряд равен нулю (q=1,000).
Кислотность
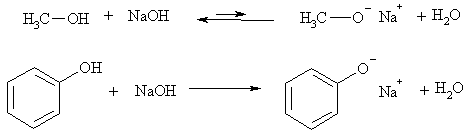
Сам фенол значительно более сильная кислота, чем любой спирт и вода. Это объясняется большей стабилизацией фенолят-иона по сравнению с алкоголят-ионами за счет делокализации отрицательного заряда по орто- и пара-положениям бензольного кольца (+М эффект О-), что легко представить с помощью граничных структур, резонансный гибрид которых описывает состояние частицы.

Следствие повышенной кислотности фенола – реакция со щелочами, в которую не вступают алифатические спирты. Однако фенол более слабая кислота, чем карбоновые кислоты и угольная кислота, поэтому он, в отличие от них, не реагирует с раствором гидрокарбоната натрия. Это простейший тест на различие спиртов, фенолов и карбоновых кислот.
Заместители в бензольном кольце фенолов влияют на кислотность следующим образом: электроноакцепторные заместители повышают, а электронодонорные понижают кислотность. Наибольшее влияние оказывают заместители, расположенные в орто- и пара-положениях кольца относительно гидроксила. Так, нитрогруппа (электроноакцептор), расположенная в орто- или пара-положениях, участвует в делокализации отрицательного заряда, стабилизируя тем самым фенолят- анион.

С увеличением числа нитрогрупп кислотность фенолов повышается до такой степени, что 2,4,6-тринитрофенол (рКа 0,42) по силе приближается к минеральным кислотам. По этой причине тринитрофенол называют пикриновой кислотой

Таблица. Значения рКа некоторых спиртов и фенолов.

Фенолы можно рассматривать в качестве оснований по причине наличия на атоме кислорода двух несвязывающих электронных пар. По сравнению со спиртами основные свойства фенола ослаблены из-за сопряжения фенольного гидроксила с бензольным кольцом.