Фенолы
Нуклеофильность фенолов и фенолят-ионов
С основностью тесно связана нуклеофильность. Фенольный гидроксил проявляет слабый нуклеофильный характер, тогда как анионы фенолов являются сильными нуклеофилами и могут участвовать в этом качестве в реакциях алкилирования, арилирования и ацилирования по атому кислорода.
При взаимодействии фенолятов щелочных металлов с алкилгалогенидами, диалкилсульфатами. Фенолы, как и другие кислоты реагирует с диазометаном (см. главу Диазосоединения), превращаясь в метилфениловые эфиры.

В синтетической химии простую эфирную группу используют в качестве защитной для гидроксигруппы. Подобно диалкиловым эфирам (см. главу Простые эфиры) алкилфениловые эфиры расщепляются йодоводородной кислотой. Бензильная группа в бензилфениловых эфирах гладко удаляется гидрогенолизом.

Реакция фенолят-анионов с арилгалогенидами, содержащими подвижный атом галогена, дает диариловые эфиры.

В присутствии оснований фенолы подвергаются ацилированию ангидридами кислот и ацилгалогенидами.

Фениловые эфиры карбоновых кислот под действием кислот Льюиса или сильных минеральных кислот претерпевают перегруппировку Фриса, в результате которой ацильная группа мигрирует в пара-положение молекулы.
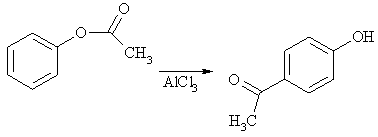
Если пара-положение занято, то ацил направляется на углеродный атом орто-положения.
Замещение гидроксила галогенами
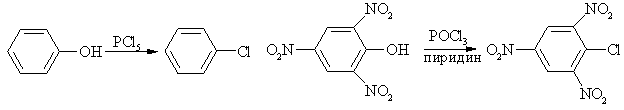
В отличие от спиртов, гидроксильная группа которых легко замещается нуклеофильными реагентами (Br-, Cl-), замещение фенольного гидроксила галогеном протекает лишь в жестких условиях при действии галогенангидридов неорганических кислот. Например, реакция пентахлорида фосфора с фенолом дает хлорбензол, а взаимодействие пикриновой кислоты с хлорокисью фосфора – пикрилхлорид.
Замещение гидроксила аминогруппой (реакция Бухерера)
При нагревании с раствором гидросульфита аммония гидроксилы в нафтолах и многоатомных фенолах обратимо замещаются на аминогруппы. Сам фенол и его гомологи в эту реакцию не вступают. Так, β-нафтол в условиях реакции Бухерера превращается в β-нафтиламин.

В основе этого превращения лежит кето-енольная таутомерия соединений фенольного ряда. Несмотря на то, что кето-енольное равновесие смещено в сторону енола (нафтола) и содержание кетонной формы незначительно, гидросульфит-ион присоединяется к кратной связи именно кетонной формы нафтола. Далее происходит присоединение молекулы аммиака к карбонильной группе, отщепление воды и гидросульфита аммония, после чего – ароматизация путем таутомерного перехода образовавшегося имина в аминонафтол.

Образование комплексных фенолятов железа (III)
Фенолы образуют ярко окрашенные комплексные соединения с катионами железа(III) и других переходных металлов. Это свойство фенолов используется в качественном анализе для их идентификации, так как различные фенолы с ионами Fe+3 дают комплексы различной окраски: фенол – темно-фиолетовой, резорцин – розовато-фиолетовый, гваякол (монометиловый эфир резорцина) – зеленый.
[Fe(H2O)6]Cl3 + 2C6H5OH → [Fe(H2O)4·C6H5OH·C6H5O]Cl2 + HCl + H2O
Окисление
Фенол и многие замещенные фенолы при хранении постепенно окисляются кислородом воздуха, образуя сложную смесь соединений. На первом этапе окисления фенолы превращаются в реакционноспособные феноксильные радикалы. Если пара-положения бензольного кольца фенолов свободны, то одним из основных превращений феноксильных радикалов является димеризация по пара-положению с образованием 4,4'-дигидроксидифенила.

Феноксильные радикалы, имеющие в орто- и пара-положениях объемные заместители, настолько стабильны, что могут существовать в растворе длительное время и даже быть выделенными в кристаллическом виде.

Антиоксидантные свойства природных соединений, содержащих фенольные фрагменты определяются их способностью связывать появляющиеся в клетках активные свободные радикалы в относительно устойчивые феноксильные радикалы.

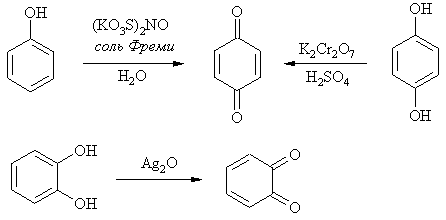
Фенол окисляется бихроматом калия или солью Фреми (нитрозодисульфонатом калия) до пара-бензохинона. При окислении двухатомных фенолов, соответственно пирокатехина и гидрохинона, образуются орто- и пара-бензохиноны.