Аминокислоты
Строение аминокислот
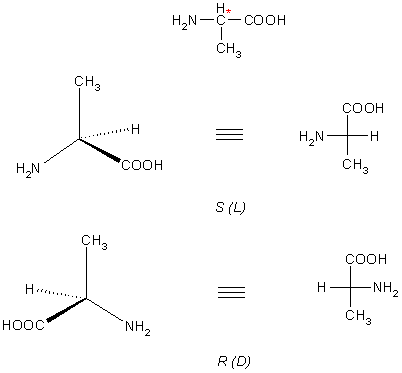
Стереоизомерия
В большинстве α-аминокислот α-углеродный атом хирален (см. главу Стереохимия). Это обусловливает существование их в виде двух оптических изомеров – R- и S-энантиомеров, или, по устаревшей номанклатуре D- и L-энантиомеров. Примечательно, что все природные аминокислоты, входящие в состав белков человека, принадлежат L-ряду, поэтому аминокислоты D-ряда часто называют "непригодными".

Некоторые α-аминокислоты (изолейцин, треонин) содержат два хиральных атома и существуют в виде 4 стереоизомеров (2 пар энантиомеров), при этом в белковых молекулах встречается только один из них.
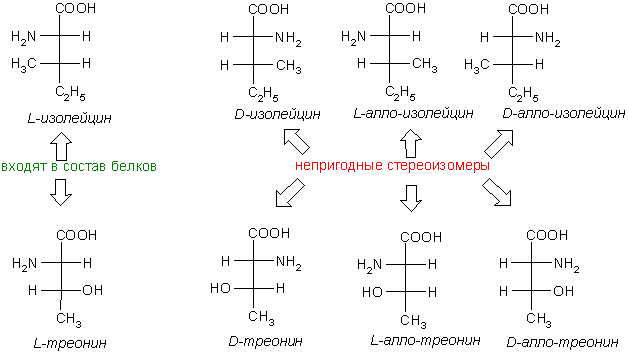
Однако D-α-аминокислоты встречаются в составе пептидов, продуцируемых микроорганизмами, например, в природных антибиотиках грамицидине и полимиксине. Кроме того, остатки D-α-аминокислот входят в состав биополимеров клеточной стенки бактерий. Так, D-глутаминовая кислота содержится в оболочке бактерий сибирской язвы – против этого вида бактерий бессильны расщепляющие ферменты человека и животных.
Присутствие в молекулах аминокислот функциональных групп кислотного (СООН) и основного (NH2) характера обусловливает амфотерность этих соединений. В водном растворе алифатические аминокислоты существуют в виде равновесной смеси биполярного иона (его называют цвиттер-ионом), катионной и анионной формы. Положение равновесия зависит от рН среды и строения аминокислоты – главным образом от наличия в составе молекулы дополнительных кислотных или основных центров. Значение рН, при котором концентрация биполярных ионов максимальна, катионная и анионная формы находятся в равных и минимальных концентрациях, называется изоэлектрической точкой (рI). Каждая аминокислота имеет индивидуальное значение рI. В этой точке суммарный заряд молекулы равен 0 и биполярные ионы не перемещаются в электрическом поле. При рН ниже pI катион аминокислоты (аммониевая форма) движется к катоду, а при рН выше pI анион аминокислоты (карбоксилат анион) перемещается к аноду. На этом основано разделение аминокислот методом электрофореза.
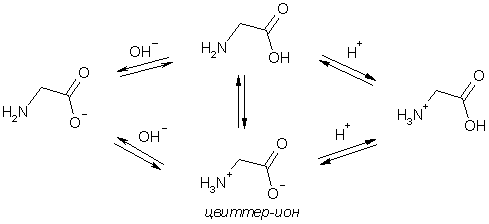
Ароматические аминокислоты не образуют цвиттер-ионов, так как основность их аминогруппы понижена из-за сопряжения с бензольным кольцом.
Значения pI некоторых α-аминокислот
| Кислота |
pI |
Кислота |
pI |
| Глицин |
6.0 |
Цистеин |
5.0 |
| Аланин |
6.0 |
Лизин |
9.8 |
| Валин |
6.0 |
Аргинин |
10.8 |
| Фенилаланин |
5.5 |
Аспарагиновая кислота |
3.0 |
| Серин |
5.7 |
Глутаминовая кислота |
3.2 |