Аминокислоты
Анализ белковых молекул
Для определения аминокислот, входящих в состав белка используют методы, основанные, как правило, на частичном или полном гидролизе полипептидной цепи. Обычно проводят кислотный или ферментативный гидролиз белка и аминокислоты анализируют различными хроматографическими методами. Таким способом можно установить количественный и качественный состав аминокислот, входящих в состав белка, но не их последовательность. Остановимся на некоторых химических способах анализа белковых молекул.
Качественные реакции
Свободные аминокислоты обнаруживают нингидринной реакцией (см. Нингидринная реакция). Эту же реакцию дают и белки, но в более жестких условиях – при кипячении с водным раствором нингидрина.
Для обнаружения пептидных связей в белках служит биуретовая реакция (реакция Пиотровского) – образование ярко-окрашенных комплексов при взаимодействии белков с гидроксидом меди (II) в присутствии щелочи. В эту реакцию вступают все пептиды, имеющие минимум две пептидные связи. Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий. Реакцию используют не только для качественного, но и для количественного определения белков.
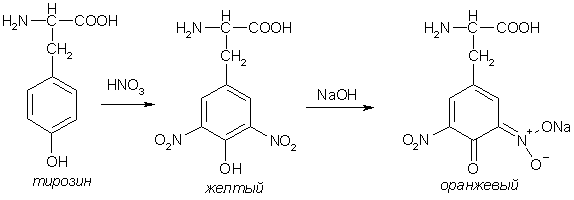
Пептиды, содержащие ароматические и гетероароматические аминокислоты дают положительную ксантопротеиновую реакцию (реакция Мульдера) – появление желтого окрашивания при действии конц. азотной кислоты. При добавлении щелочи цвет смеси меняется на оранжевый.

Серосодержащие аминокислоты в составе белка определяют по образованию черного осадка сульфида свинца при нагревании с ацетатом свинца – сульфгидрильная реакция (реакция Фоля).
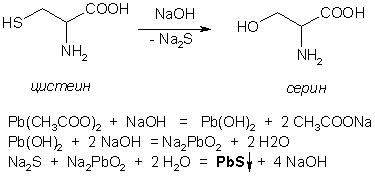
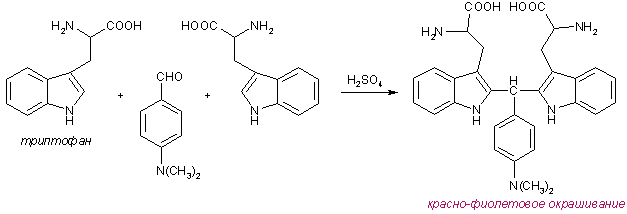
Триптофан обнаруживают при помощи реакции с п-диметиламинобензальдегидом в среде серной кислоты – реакция Эрлиха. Образующийся продукт конденсации имеет красно-фиолетовое окрашивание.
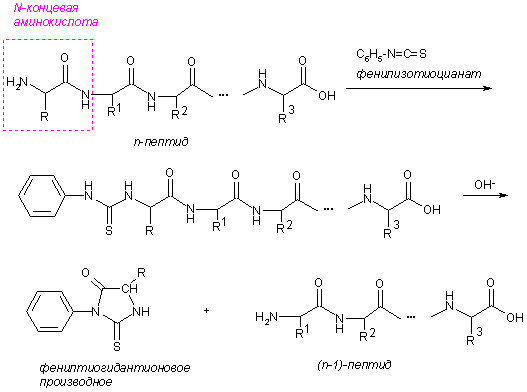
Определение С- и N-концевых аминокислот
N-Концевые аминокислоты определяют по реакции с 2,4-динитрофторбензолом или дансилхлоридом. Свободная аминогруппа N-концевой аминокислоты арилируется или ацилируется, белок гидролизуют, образовавшиеся N-(2,4-динитрофенил)- (А) или N-(5-диметиламинонафтил-1-сульфо)производные (Б) существенно отличаются по физико-химическим свойствам от остальных аминокислот, поэтому их легко отделяют и идентифицируют.
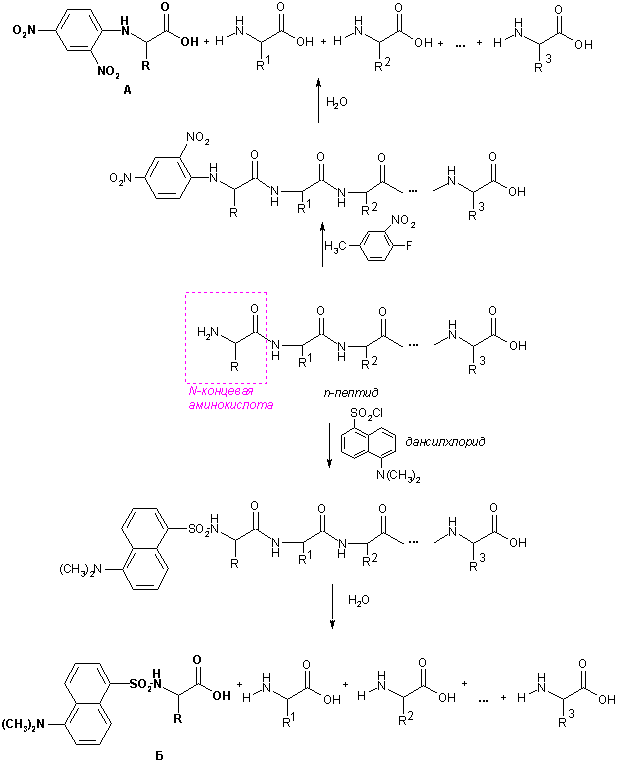
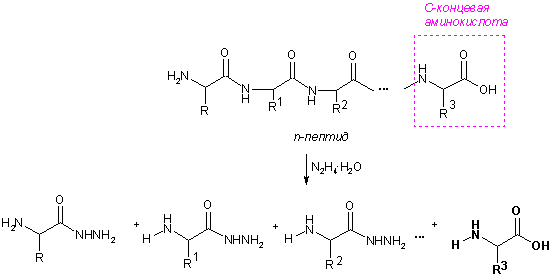
С-Концевые аминокислоты определяют методом Акароби – при нагревании пептида с гидразингидратом пептидные связи гидролизуются и образуется смесь гидразидов аминокислот. С-Концевая аминокислота не реагирует с гидразином, остается в свободном виде, ее выделяют и идентифицируют.
Удобным методом определения последовательности аминокислот (первичной структуры белка) является способ деградации полипептидной цепи с помощью фенилизотиоцианата (метод Эдмана). N-Концевые аминокислоты последовательно отщепляются от цепи в виде фенилтиогидантоинов и идентифицируются.