Алкилгалогениды.
Реакции нуклеофильного замещения.
Реакции элиминирования
Бимолекулярное замещение (SN2)
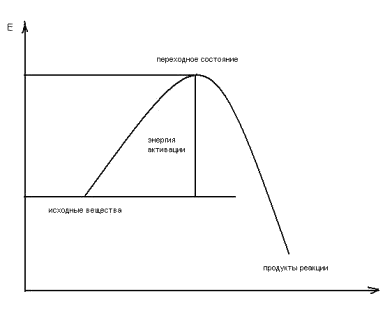
Выше было показано, что реакция метилбромида с гидроксид-ионом является бимолекулярным нуклеофильным замещением (SN2). Ввиду того, что, кроме разрыва связи C-Br и образования связи C-O, других изменений в системе не происходит, можно утверждать, что процес происходит в одну стадию, т.е. является синхронным. Нуклеофил, атакуя молекулу субстрата, отдает свою электронную пару электронодефицитному атому углерода. Одновременно происходит разрыхление связи С-Br. Такое состояние называется переходным, его можно изобразить как частицу с пятикоординированным углеродом. На энергетическом профиле реакции ему соответствует максимум, который соответствует энергии активации.

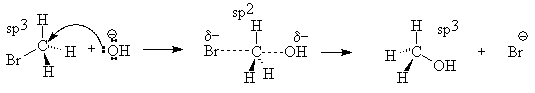
Очевидно, что в такой реакции наиболее удобна атака нуклеофила с обратной стороны относительно брома (атака с тыла), т.к. в противном случае неизбежно возникнет сильное отталкивание между неподеленными электронными парами нуклеофила и уходящей группы. Поэтому гидролиз оптически активных соединений приводит к образованию спиртов с противоположной абсолютной конфигурацией. Так, из R-2-бромоктана образуется энантиомер S-ряда. В таких случаях говорят, что реакция происходит с обращением конфигурации (Вальденовское обращение). Это явление считается одним из важнейших аргументов в пользу механизма SN2.
В пользу рассматриваемой схемы процесса свидетельствует зависимость скорости гидролиза от строения галогеналкана. В отличие от реакций с участием карбокатионов и радикалов, переходное состояние (ПС) в реакции SN2 нельзя охарактеризовать как некую промежуточную частицу между исходным и конечным соединениями. ПС не имеет разделенных зарядов, и стабилизирующие факторы, основанные на электронных эффектах, в нем не действуют. Поэтому протеканию бимолекулярной реакции способствуют слабо ионизирующие, неполярные или малополярные растворители (эфир, ацетон, ацетонитрил, диметилсульфоксид). На скорость реакции в первую очередь оказывает влияние пространственная доступность реакционного центра субстрата: с увеличением вблизи него количества объемных групп образование переходного состояния требует большей энергии и реакция замедляется. Это видно из величин сравнительных скоростей реакции гидролиза бромалканов:
· бромметан 150
· бромэтан 1
· 2-бромпропан 0,01
· 2-метил-2-бромпропан 0,001
Механизм SN2 характерен в первую очередь для метилгалогенидов и первичных алкилгалогенидов. Вторичные галогеналканы вступают в эту реакцию медленнее, а третичные реагируют преимущественно по механизму SN1 (см. ниже).
На протекание SN2-реакции существенное влияние оказывает также природа галогена: чем прочнее связь углерод-галоген, тем ниже реакционная способность субстрата. Наиболее прочна связь во фторидах (теплота диссоциации + образования фторид-иона +143 кДж/моль), а наибольшую реакционную способность проявляют иодалканы (теплота диссоциации + образования иодид-иона -80 кДж/моль).
![]()