
Алкилгалогениды.
Реакции нуклеофильного замещения.
Реакции элиминирования
Мономолекулярное замещение (SN1)
Как говорилось выше, скорость гидролиза трет-бутилбромида зависит только от концентрации субстрата. Это объясняется тем, что реакция идет в две стадии, причем в лимитирующей стадии гидроксид-ион не участвует. Считается, что на первой стадии трет-бутилбромид диссоциирует на катион трет-бутилия и бромид-ион. Движущей силой этого процесса является относительная устойчивость трет-бутил-катиона, стабилизированного донорным эффектом СН3-групп..

Эта стадия – самая медленная и она лимитирует скорость реакции. Затем следует атака нуклеофила и образуется спирт, причем вторая стадия протекает быстрее вследствие высокой электрофильности карбкатиона.

Описанный механизм называют мономолекулярным (SN1), потому что в лимитирующей стадии участвует одна молекула, а не две, как это происходит в механизме SN2. Поэтому энергетический профиль SN1-реакции имеет два максимума, соответствующие энергиям активации двух переходных состояний. В переходном состоянии 1 происходит разрыхление связи C-Br, после чего она разрывается. Переходное состояние 2 соответствует зарождению связи C-OH, которое завершается ее окончательным формированием и образованием молекулы спирта.
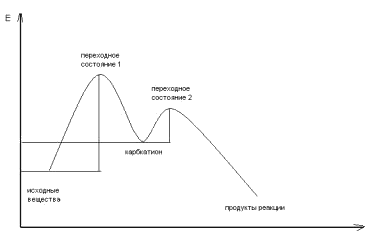
Если разница между величинами энергий активации обоих переходных состояний невелика, реакция обратима и равновесие устанавливается в зависимости от концентрации нуклеофилов и прочности их связи с С-атомом субстрата. Ряд реакционной способности бромалканов в SN1-реакциях имеет порядок, обратный реакциям SN2. Это видно по величинам относительных скоростей реакции гидролиза бромалканов в водной муравьиной кислоте:
· 2-бром-2-метилпропан 100 000 000
· 2-бромпропан 45
· бромэтан 1,7
· бромметан 1,0
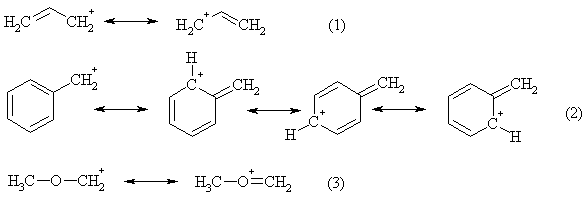
Это связано с тем, что в реакции SN1, медленной стадией которой является ионизация субстрата, которую более легко претерпевают те соединения, при диссоциации которых образуется более устойчивый карбокатион. Стабилизация катионов может достигаться двумя путями: либо в результате +I-эффекта алкильных групп, либо благодаря +M-эффекту кратных связей, ароматических колец или неподеленных электронных пар гетероатомов. К катионам первого типа относятся трет-бутильный и другие третичные алифатические катионы, примерами катионов второго типа являются аллильные (1), бензильные (2), алкоксиалкильные (3) и т.д.
Диссоциация происходит эффективнее с сильнополярном растворителе, хорошо сольватирующем ионы. Поэтому SN1-реакции лучше идут именно в таких растворителях, как вода, спирты, уксусная и муравьиная кислота и др.
В качестве доказательства мономолекулярного механизма, кроме кинетики процесса, используются результаты изучения стереохимического хода реакции. Центральный атом промежуточного карбкатиона находится в состоянии sp2-гибридизации и имеет плоскую геометрию, поэтому нуклеофильная атака равновероятна с обеих сторон плоскости. Следствием этого является образование рацемической смеси продуктов замещения при хиральном центре, но не соединений с обращенной конфигурацией (как это имело место в бимолекулярном механизме).
Карбкатионы могут претерпевать скелетные перегруппировки, приводящие к стабилизации катионного центра. Чаще всего происходит превращение первичных катионов во вторичные или третичные. Например, 1-бром-2,3-диметилпропан (неопентилбромид) реагирует по механизму SN2 с этилатом натрия (сильный нуклеофил), превращаясь в этилнеопентиловый эфир, тогда как при взаимодействии с этанолом (механизм SN1) в результате перегруппировки образует этил-трет-пентиловый эфир.
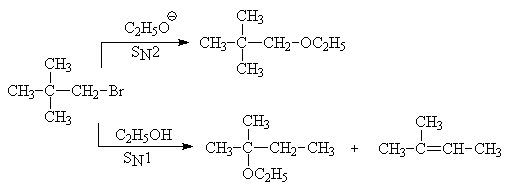
Отметим, что из карбкатиона после перегруппировки наряду с продуктом замещения образуется непредельное соединение. Это свидетельствует о том, что процесс идет двумя конкурирующими реакциями замещением (SN1) и отщеплением (Е1).
Таким образом, замещение по механизму SN1 идет лишь в тех случаях, когда промежуточный карбкатион имеет низкую энергию и потому, легко образуясь, существует в смеси относительно долгое время (аллилхлорид, бензилхлорид, хлорметиловый эфир). Важнейшую роль в стабилизации карбкатиона играют электронные факторы – донорные индуктивный и мезомерный эффекты заместителей, связанных с катионным центром..
Примечательным является различие в химической активности винилбромида и аллилбромида. Скорости замещения в них брома иодом относятся как 0,014:438. Пассивность винилгалогенидов объясняют, во-первых, повышенной прочностью связи С-галоген и малым дипольным моментом, во-вторых, трудностью образования переходного состояния. Последнее обусловлено тем, что из-за плоской геометрии винильной молекулы нуклеофил не может подойти к электронодефицитному центру (мешает p-электронное облако), недостаток электронной плотности на котором не столь уж велик. Кроме того, винилгалогенид неспособен реагировать по SN1-механизму, т.к. соответствующий катион не может быть стабилизирован резонансом (вакантная орбиталь является гибридной и не вступает в сопряжение с π-системой).

Напротив, аллильный катион резонансно-стабилизирован и поэтому аллибромид легко диссоциирует. Поэтому нуклеофильное замещение в нем идет преимущественно по мономолекулярному механизму, тогда как вклад механизма SN2 невелик.

Таким образом, механизм SN1 реализуется в соединениях, способных к образованию стабилизированного карбкатиона, протекают в ионизирующем растворителе при действии слабых нуклеофилов или низкой концентрации сильных нуклеофилов. Для проведения SN2-реакции более подходят первичные галогеналканы, реакция требует участия сильных нуклеофилов в малополярных и неионизирующих растворителях. Следует отметить, что реакции нуклеофильного замещения практически почти никогда не идут по одному механизму, в зависимости от условий один или другой механизм реализуется в бóльшей степени.