Алкилгалогениды.
Реакции нуклеофильного замещения.
Реакции элиминирования
Реакции элиминирования
β-Элиминирование
Как было ранее подчеркнуто, параллельно с SN1-замещением в третичных галогеналканах протекает реакция элиминирования, приводящяя к образованию алкенов. В то же время, реакции SN2 тоже осложняются элиминированием, причем в некоторых случаях это становится основным процессом. Так, действием на вторичные и первичные галогеналканы спиртовыми растворами щелочей или алкоголятов щелочных металлов получают непредельные углеводороды. И в том, и в другом случае происходит отщепление молекулы галогеноводорода от двух соседних углеродных атомов.
При протекании реакции по механизму SN1 промежуточный катион может быть атакован нуклеофилом не только по электрофильному центру (катионному атому углерода), но также по одному из соседних атомов водорода (в этом случае нуклеофил считается основанием). Это связано с тем, что на соседних атомах углерода наведен небольшой положительный заряд, что дезэкранирует водородные атомы, облегчая их отщеплению при подходе основания.

Как и в реакции SN1, лимитирующей стадией данного превращения является образование карбокатиона, что происходит при участии одной молекулы. Поэтому его называют реакцией мономолекулярного отщепления (элиминирования) и обозначают символом Е1.
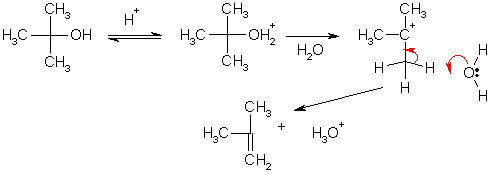
По механизму Е1 легко протекает дегидратация третичных спиртов. Например образование изобутилена из трет-бутилового спирта происходит в результате нагревания с 15%-ной серной кислотой.

Третичные галогеналканы при 40 °С в спирте реагируют по мономолекулярным механизмам замещения и отщепления параллельно, при этом среди продуктов реакции преобладает тот алкен, в молекуле которого при двойной связи находится большее количество заместителей. Эта закономерность имеет общий характер и называется правилом Зайцева. Такую ориентацию элиминирования можно объяснить сравнительной термодинамической стабильностью этиленовых углеводородов. В соответствии с величинами теплот гидрирования алкенов, их устойчивость тем выше, чем больше заместителей присутствует при двойной связи.
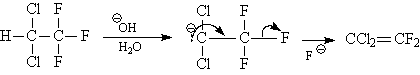
Когда в молекуле субстратов присутствует большое количество электроноакцепторных заместителей, постулируется другой механизм мономолекулярного β-элиминирования. Сначала, в результате отщепления протона, быстро образуется стабилизированный карбанион, а на второй стадии происходит отщепление галогенид-иона. Лимитирующей является стадия образования карбаниона, который является сопряженным основанием исходному субстрату. Поэтому механизм обозначается E1CB. Этот механизм реализуется, например, в реакции дегидрофторирования 1,1-дихлор-2,2,2-трихлорэтана.
Реакцию отщепления галогеноводорода от вторичных и первичных галогеналканов можно представить как синхронный процесс, происходящий при действии нуклеофила, который в этих условиях выполняет роль основания.

В этом случае реакция протекает при участии двух молекул и относится к бимолекулярным (Е2). При наличии альтернативных положений возможного элиминирования протона реакция идет так, что он, как в третичных галогеналканах, отщепляется преимущественно от более замещенного атома углерода (правило Зайцева).

Для описания реакции дегидратации первичных спиртов предложен Е2-механизм. Так, этанол сначала образует с серной кислотой моноэтилсульфат, который вступает далее в реакцию элиминирования при участии молекулы воды по синхронному механизму.

Напротив, при термолизе или обработке сильными основаниями тетраалкиламмониевых оснований доминирует менее замещенный алкен. Такие реакции называют протекающими по правилу Гоффмана.

Объяснение различной ориентации отщепления состоит в структуре переходного состояния.

Легко видеть, что в E1cB – переходном состоянии ориентация отщепления определяется легкостью отрыва протона, которая связана с поляризуемостью связи С-Н в направлении углерода. При этом, чем меньше алкильных (донорных) заместителей находится при этом атоме, тем легче разрывается связь С-Н под действием основания. Поэтому в том случае, когда ПС реакции по структуре ближе к карбаниону, т.е. когда уходящая группа является сильным электроноакцептором, среди продуктов преобладает менее замещенный алкен (реализуется правило Гофмана).
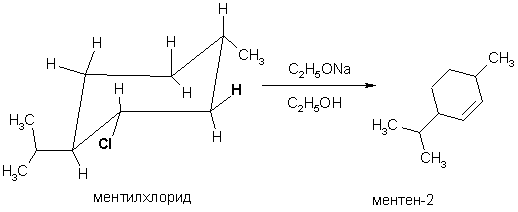
Нужно отметить, что реакции, протекающие по механизму Е2 являются не только регио-, но и стереоселективными. В большинстве случаев анти-элиминирование является более предпочтительным по сравнению с син-элиминированием, т.к. энергетический барьер реакции отщепления из более стабильной заторможенной конформации А обычно ниже такового из менее стабильной заслоненной конформации Б.

Предпочтительность анти-перипланарного расположения H и Hal в большинстве реакций Е2-элиминирования подтверждается экспериментальными фактами о реакционной способности галогеналканов, в которых свободное вращение вокруг связи С-С невозможно. Так, при действии этилата натрия в спирте на метилхлорид (условия Е2-реакции) в результате транс-элиминирования образуется ментен-2, несмотря на то, что альтернативный ментен-3 (продукт Зайцева) более стабилен.